题目内容
【题目】海水是资源的宝库,海水淡化可获得淡水和浓海水。浓海水中主要含有的离子有Na+、 Mg2+ 、Cl﹣、SO42﹣。从浓海水中提取金属镁的一段工艺流程如图所示:
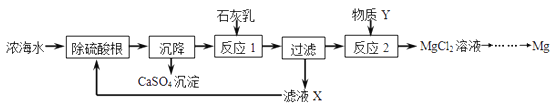
(1)写出反应2的化学方程式:_________________________________________。
(2)操作流程中可循环使用的物质是___________(填化学式)。
(3)在实验室如何证明溶液中的SO42﹣已完全沉淀:_____________________________ 。
【答案】2HCl+ Mg(OH)2= MgCl2+ 2H2OCaCl2取适量静置后的上层清液于试管中,再滴加适量BaCl2(若写CaCl2也给分)溶液,若无沉淀,证明SO42-已完全沉淀
【解析】
(1)反应2是将氢氧化镁转化为氯化镁;(2)根据流程图来分析;(3)SO42﹣的检验,注意答题叙述要严谨。
(1)反应2是将氢氧化镁转化为氯化镁,需加入盐酸,二者反应生成氯化镁和水,故方程式为:2HCl+ Mg(OH)2= MgCl2+ 2H2O;(2)根据流程图可知,氯化钙可用于循环使用,即:CaCl2;(3)在实验室如何证明溶液中的SO42﹣已完全沉淀:取适量静置后的上层清液于试管中,再滴加适量BaCl2(若写CaCl2也给分)溶液,若无沉淀,证明SO42-已完全沉淀。

练习册系列答案
相关题目