题目内容
【题目】磷及部分重要化合物的相互转化如图所示。
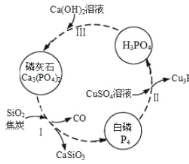
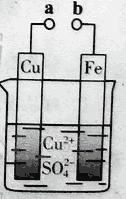
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
【答案】0.05mol CaHPO4、Ca(H2PO4)2 1.66 114.87 2.91
【解析】
(1)依据氧化还原反应中得失电子守恒,结合铜元素、磷元素化合价的变化进行计算;
(2)依据磷酸与氢氧化钙量不同,得到的产物可能是正盐或者酸式盐;
(3)磷灰石中碳元素的质量分数=二氧化碳质量分数×二氧化碳中碳元素质量分数;
(4)根据钙元素守恒计算;
(5)用m表示出磷灰石中Ca、S、P元素物质的量,计算出磷酸中P元素物质的量、硫酸中S元素物质的量,结合化学式可知n(Ca)=n(S)+![]() n(P),据此列方程解答。
n(P),据此列方程解答。
(1)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,根据得失电子守恒可知,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(50)=1mol×(21),解得n=0.05mol,故答案为:0.05mol;
(2)磷酸为三元酸,与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能有:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2,故答案为:CaHPO4、Ca(H2PO4)2;
(3)磷灰石中碳元素的质量分数=![]() ,故答案为:1.66;
,故答案为:1.66;
(4)100g磷灰石粉末中Ca元素质量=![]() ,钙元素全部以CaSO4的形式存在,根据Ca元素守恒可知,可以得到CaSO4的质量=
,钙元素全部以CaSO4的形式存在,根据Ca元素守恒可知,可以得到CaSO4的质量=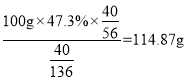 ,故答案为:114.87;
,故答案为:114.87;
(5)mg磷灰石中Ca元素物质的量=![]() ,S元素物质的量=
,S元素物质的量=![]() ,P元素物质的量=
,P元素物质的量=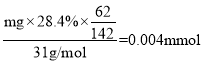 ,磷酸中P元素物质的量=0.05L×0.5mol/L=0.025mol,硫酸中S元素物质的量=0.05L×0.1mol/L=0.005mol,由化学式可知,n(Ca)=n(S)+
,磷酸中P元素物质的量=0.05L×0.5mol/L=0.025mol,硫酸中S元素物质的量=0.05L×0.1mol/L=0.005mol,由化学式可知,n(Ca)=n(S)+![]() n(P),故0.00845m=(0.00044m+0.005)+
n(P),故0.00845m=(0.00044m+0.005)+ ![]() (0.004m+0.025),解得m=2.91,故答案为:2.91。
(0.004m+0.025),解得m=2.91,故答案为:2.91。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】滴定法不仅适合于酸碱中和滴定,还可以用于氧化还原滴定和沉淀滴定。
I. 甲同学根据反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,进行测定H2C2O4溶液的物质的量浓度的实验。实验步骤如下:
①取待测H2C2O4溶液25.00 mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1 mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00 mL。请回答:
(1)滴定时,将KMnO4溶液装在 __________(填“酸式”或“碱式”)滴定管中。
(2)滴定过程中眼睛注视 __________。
(3)计算H2C2O4溶液的物质的量浓度为 ________mol/L。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 _________(填字母代))。
A 滴定终点读数时俯视 B 取用待测液的滴定管水洗后未用待测液润洗
C 锥形瓶水洗后未干燥 D 装标准液的滴定管尖嘴部分有气泡,滴定后消失
II. 已知:
AgCl | AgBr | AgSCN | Ag2CrO4 | AgCN | |
溶解度(mol/L) | 1.34×10-6 | 7.1×10-7 | 1.0×10-6 | 6.5×10-5 | 1.1×10-8 |
颜色 | 白 | 淡黄 | 白 | 砖红 | 白 |
(5)①乙同学参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是_______(填字母代号)。
a CaCl2 b NaBr c NaCN d K2CrO4
②滴定达终点的现象是___________。
【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
【题目】能源、材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示。若该原子核外电子有三层,则该元素位于周期表______族,写出A燃烧后形成的氧化物的电子式:______.
I1 | I2 | I3 | I4 | … | |
电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是______(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:______。
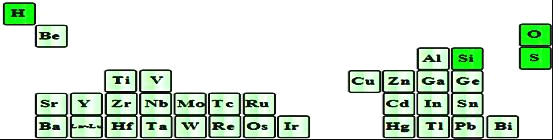
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为______,该物质为______分子(选填“极性”或“非极性”)。
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:______。
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是______(选填编号)。
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少2/3
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2。