题目内容
【题目】常温下,向20mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
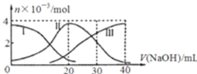
A.滴加过程中当溶液呈中性时,![]()
B.当![]() 时,则有:
时,则有:![]()
C.H![]() 在水中的电离方程式是:H
在水中的电离方程式是:H![]() ;
;![]()
D.当![]() 时,则有:
时,则有:![]()
【答案】D
【解析】
A.当![]() 时,此时溶质为NaHA,根据图象可知溶液中离子浓度
时,此时溶质为NaHA,根据图象可知溶液中离子浓度![]() ,说明
,说明![]() 的电离程度大于其水解程度,溶液为酸性,如果溶液为中性,则
的电离程度大于其水解程度,溶液为酸性,如果溶液为中性,则![]() ,故A错误;
,故A错误;
B. 当![]() 时,此时溶质为NaHA和
时,此时溶质为NaHA和![]() ,根据物料守恒,则有:
,根据物料守恒,则有:![]() ,故B错误;
,故B错误;
C. ![]() 是二元弱酸,在水中的电离是分步电离的,电离方程式是:
是二元弱酸,在水中的电离是分步电离的,电离方程式是:![]() 、
、![]() ,故C错误;
,故C错误;
D. 根据图象知,当![]() mL时,发生反应为
mL时,发生反应为![]() ,溶质主要为NaHA,
,溶质主要为NaHA,![]() 电离程度大于水解程度,溶液显酸性,水和
电离程度大于水解程度,溶液显酸性,水和![]() 都电离出氢离子,只有
都电离出氢离子,只有![]() 电离出
电离出![]() ,所以离子浓度大小顺序是
,所以离子浓度大小顺序是![]() ,故D正确;
,故D正确;
答案选D。

练习册系列答案
相关题目