题目内容
【题目】A、B、C、D、E、F代表原子序数依次增大的前四周期元素。其中A是空气中含量最高的元素;B是同周期中原子半径最大的元素;C原子的最外层电子数与核外电子层数相等;D、E元素的基态原子3p能级上都有两个未成对电子;F原子的外围电子排布为(n-1)d10ns1。根据以上信息,回答下列问题:
(1)A元素基态原子核外电子的轨道表达式为________________;在同周期元素中第一电离能介于C、E之间的元素是______(用化学式表示)。
(2)将以下三种物质:①A与硼元素按原子个数比为1∶1形成的空间网状结构化合物,②B的氯化物, ③D的氯化物。按熔点由高到低的顺序排列:______________(用化学式表示)。
(3)A的最简单氢化物易液化,其原因是_______________,E的次高价含氧酸根离子的VSEPR模型名称是_________,该离子的空间构型为__________。
(4)F单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
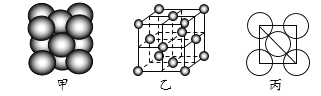

若已知F晶胞参数为a pm,F相对原子质量为M,NA代表阿伏加德罗常数,请回答:
①晶胞中F原子的配位数为_______;F单质晶体中原子的堆积方式是_________堆积。
②F原子半径r =________pm,F单质晶体密度计算式为:______________ g·cm-3。
(5)A与F形成的某种化合物晶胞结构如图丁所示,该晶体的化学式为___________。该化合物能与稀盐酸剧烈反应,生成一种白色沉淀和一种全部由非金属元素组成的离子化合物,该反应的化学方程式为________。
【答案】1s22s22p3 Mg、Si BN>NaCl> SiCl4 分子间存在氢键 正四面体 三角锥形 12 面心立方堆积 ![]() a
a ![]() Cu3N Cu3N+4HCl= NH4Cl+3CuCl↓
Cu3N Cu3N+4HCl= NH4Cl+3CuCl↓
【解析】
A是空气中含量最高的元素则A为N; D、E元素的基态原子3p能级上都有两个未成对电子,则核外电子排布式为1s22s22p63s23p2或1s22s22p63s23p4,故D为Si、E为S,B是同周期中原子半径最大的元素,则B是Na;C原子的最外层电子数与核外电子层数相等,则C为Al;F原子的外围电子排布为(n-1)d10ns1,则F为29号元素Cu。
(1)A为N元素,基态原子核外电子的轨道表达式为1s22s22p3;C为Al,E为S,P最外层为半充满状态所以第一电离能大于S,Mg的3s轨道为全满状态,所以第一电离能大于Al,所以介于Al和S之间的元素有Mg、Si;
(2)A与硼元素按原子个数比为1∶1形成的空间网状结构化合物为BN;为原子晶体,B的氯化物为NaCl,为离子晶体;D的氯化物为SiCl4,为分子晶体,所以熔点由高到低为:BN>NaCl> SiCl4;
(3)A的最简单氢化物为NH3,分子间存在氢键,溶液液化;E的次高价含氧酸根为SO32-,价层电子对数为4,孤电子对数为1,所以其VSEPR模型为正四面体,空间构型为三角锥形;
(4)①根据图示可知该堆积方式为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;
②据图可知面对角线上的三个晶胞相切,所以有(4r)2=2a2,解得r=![]() a pm;该晶胞中所含F原子的个数为
a pm;该晶胞中所含F原子的个数为![]() ,所以质量m=
,所以质量m=![]() g,晶胞体积为V=a3 pm3=a3×10-30cm3,所以密度
g,晶胞体积为V=a3 pm3=a3×10-30cm3,所以密度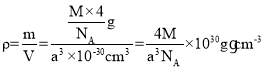 ;
;
(5)A为N,F为Cu,据图可知一个晶胞中含有Cu原子的个数为![]() =3,含有N原子的个数为
=3,含有N原子的个数为![]() =1,所以该晶体的化学式为Cu3N;全部由非金属元素组成的离子化合物应为NH4Cl,氮、氯元素的化合价没有发生变化,生成的沉淀为白色可知不是铜单质,则铜元素化合价不变,白色沉淀为CuCl,所以该反应的化学方程式为:Cu3N+4HCl= NH4Cl+3CuCl↓。
=1,所以该晶体的化学式为Cu3N;全部由非金属元素组成的离子化合物应为NH4Cl,氮、氯元素的化合价没有发生变化,生成的沉淀为白色可知不是铜单质,则铜元素化合价不变,白色沉淀为CuCl,所以该反应的化学方程式为:Cu3N+4HCl= NH4Cl+3CuCl↓。

 阅读快车系列答案
阅读快车系列答案【题目】磷及部分重要化合物的相互转化如图所示。
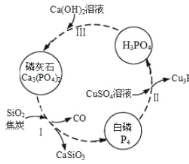
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)。
2CO2+N2+Q(Q>0)。
在某温度下测得该反应在不同时间的CO浓度如下表:
浓度(mol/L) 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)该反应平衡常数K的表达式为___;温度升高,K值___(选填“增大”“减小”“不变”);前2s的平均反应速率v(N2)=___;若上诉反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是___。
(2)工业合成氨的反应温度选择500℃左右的原因是___。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___。
A.N2、H2、NH3的浓度之比为1:3:2
B.容器内的压强保持不变
C.N2、H2、NH3的浓度不在变化
D.反应停止,正、逆反应的速率都等于零
(4)常温下向1molHCl的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是___;在通入NH3的过程中溶液的导电能力___(选填“变大”“变小”“几乎不变”)
【题目】下列对有关微粒的相互关系和特征描述正确的是( )
选项 | 微粒 | 相互关系 | 特征描述 |
A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A. A B. B C. C D. D
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
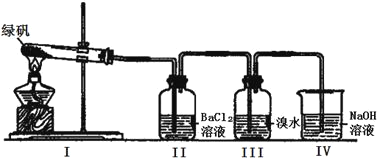
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。
【题目】下列实验不能达到预期目的是( )
实验操作 | 实验目的 | |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D