题目内容
【题目】滴定法不仅适合于酸碱中和滴定,还可以用于氧化还原滴定和沉淀滴定。
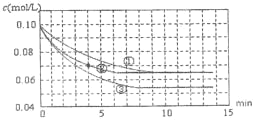
I. 甲同学根据反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,进行测定H2C2O4溶液的物质的量浓度的实验。实验步骤如下:
①取待测H2C2O4溶液25.00 mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1 mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00 mL。请回答:
(1)滴定时,将KMnO4溶液装在 __________(填“酸式”或“碱式”)滴定管中。
(2)滴定过程中眼睛注视 __________。
(3)计算H2C2O4溶液的物质的量浓度为 ________mol/L。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 _________(填字母代))。
A 滴定终点读数时俯视 B 取用待测液的滴定管水洗后未用待测液润洗
C 锥形瓶水洗后未干燥 D 装标准液的滴定管尖嘴部分有气泡,滴定后消失
II. 已知:
AgCl | AgBr | AgSCN | Ag2CrO4 | AgCN | |
溶解度(mol/L) | 1.34×10-6 | 7.1×10-7 | 1.0×10-6 | 6.5×10-5 | 1.1×10-8 |
颜色 | 白 | 淡黄 | 白 | 砖红 | 白 |
(5)①乙同学参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是_______(填字母代号)。
a CaCl2 b NaBr c NaCN d K2CrO4
②滴定达终点的现象是___________。
【答案】酸式 锥形瓶内溶液颜色的变化 0.2 D d 滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色
【解析】
I⑴滴定时,将KMnO4具有强氧化性。
⑵滴定过程中眼睛注视锥形瓶内溶液颜色的变化。
⑶根据高锰酸钾与草酸的关系式计算草酸的物质的量,再计算H2C2O4溶液的物质的量浓度。
⑷A. 滴定终点读数时俯视,读出消耗标液减少,误差偏低;B. 取用待测液的滴定管水洗后未用待测液润洗,待测液物质的量减少,消耗标液体积减少,误差偏低;C. 锥形瓶水洗后未干燥,对结果无影响;D. 装标准液的滴定管尖嘴部分有气泡,滴定后消失,读出标液偏高,误差偏高。
II. ⑸①硝酸银标准溶液滴定氯离子含量时,指示剂应当选择溶解度比氯化银溶解度大且有明显颜色的。
②滴定达终点的现象是滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色。
I⑴滴定时,将KMnO4具有强氧化性,因此溶液装在酸式滴定管中;故答案为:酸式。
⑵滴定过程中眼睛注视锥形瓶内溶液颜色的变化,故答案为;锥形瓶内溶液颜色的变化。
⑶根据方程式比例关系:2KMnO4 — 5H2C2O4,草酸的物质的量![]() ,则H2C2O4溶液的物质的量浓度
,则H2C2O4溶液的物质的量浓度![]() ;故答案为:0.2。
;故答案为:0.2。
⑷A. 滴定终点读数时俯视,读出消耗标液减少,误差偏低,故A不符合题意;B. 取用待测液的滴定管水洗后未用待测液润洗,待测液物质的量减少,消耗标液体积减少,误差偏低,故B不符合题意;C. 锥形瓶水洗后未干燥,对结果无影响,故C不符合题意;D. 装标准液的滴定管尖嘴部分有气泡,滴定后消失,读出标液偏高,误差偏高,故D符合题意;综上所述,答案为D。
II. ⑸①硝酸银标准溶液滴定氯离子含量时,指示剂应当选择溶解度比氯化银溶解度大且有明显颜色的,Ag2CrO4沉淀符合,因此作指示剂的是K2CrO4;故答案为:d。
②滴定达终点的现象是滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色;故答案为:滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色。

【题目】在恒温恒容的密闭容器中按照下表甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g) ![]() 2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反应向逆向进行
B.达到平衡时,甲、乙、丙三容器中NH3体积分数的大小顺序:甲=乙>丙
C.乙中的NH3转化率为40%
D.若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,重新达到平衡时,体系中NH3体积分数不变
【题目】用如图所示装置分别进行实验,请回答下列问题:
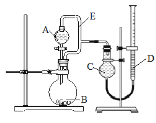
实验 | A中试剂 | B中试剂 | C中液体 |
I | 饱和食盐水 | 电石 | H2O |
II | 浓氨水 | NaOH固体 | CCl4 |
III | 生铁 | H2O | |
IV | NaOH溶液 | 镁铝合金 | H2O |
(1)导管E的作用是:____________________、_________________;
(2)实验I烧瓶B中发生反应的化学方程式是________,产生的气体经验纯后点燃,现象是___________;
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是___________;

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用__________(填序号);
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_________;
(5)写出实验IV中发生反应的离子方程式_________;若读数时C管液面低于D管液面,则测出的镁铝合金中镁的质量分数将_______(填“偏高”、“偏低”或“无影响”)。
【题目】磷及部分重要化合物的相互转化如图所示。
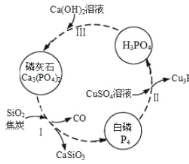
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。