题目内容
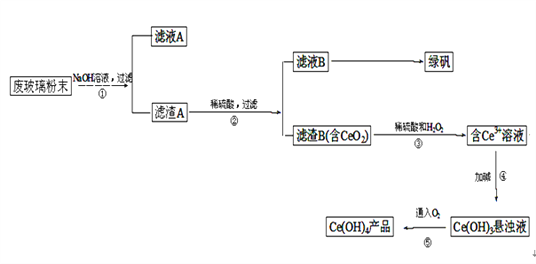
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
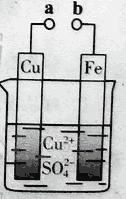
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
【答案】D
【解析】
A.a和b不连接时,铁和铜离子发生置换反应,所以铁片上有铜析出,故A正确;B.a和b连接时,该装置构成原电池,铁作负极,铜作正极,正极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B正确;C.无论a和b是否连接,铁都失电子发生氧化反应,所以铁都溶解,故C正确;D.a和b分别连接直流电源正、负极,在电解池中阳离子向负极移动,铜离子向铁电极移动,故D错误;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列有关物质的分类全部正确的是
选项 | 物质 | 分类 |
A | 雾霾、水银、冰水混合物 | 混合物 |
B | Ba(OH)2、烧碱、生石灰 | 碱 |
C | 氯化钠、CaCO3、无水硫酸铜 | 盐 |
D | CO、CO2、Mn2O7 | 酸性氧化物 |
A.AB.BC.CD.D
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
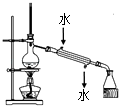
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .