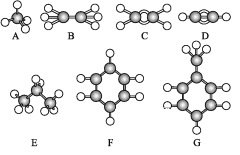
题目内容
【题目】NH5属于离子晶体。与水反应的化学方程式为:NH5+H2O→NH3H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。有关NH5叙述正确的是( )
A.与乙醇反应时,NH5被氧化
B.NH5中N元素的化合价为+5价
C.1molNH5中含有5molN-H键
D.1molNH5与H2O完全反应,转移电子2mol
【答案】A
【解析】
反应NH5+H2O→NH3H2O+H2↑,NH5的5个H原子中有1个H原子,化合价由﹣1价变为0价,水中H元素化合价由+1价变为0价,所以NH5作还原剂,水作氧化剂,
A.NH5也能跟乙醇发生类似的反应,并都产生氢气,则乙醇作氧化剂,NH5作还原剂而被氧化,A正确;
B.NH5的电子式为![]() ,N元素的化合价为﹣3价,B错误;
,N元素的化合价为﹣3价,B错误;
C.NH5的电子式为![]() ,1 mol NH5中含有4molN-H键,C错误;
,1 mol NH5中含有4molN-H键,C错误;
D.1 mol NH5与H2O完全反应,转移电子的物质的量=1mol×[0-(-1)]=1mol,D错误;
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】磷及部分重要化合物的相互转化如图所示。
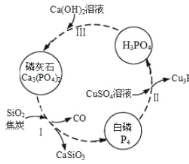
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
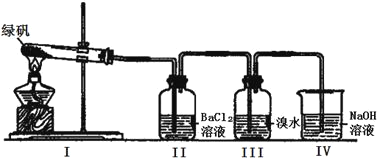
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。