��Ŀ����
����Ŀ����Դ�������ѳ�Ϊ�����ѧ�о����ȵ㡣��ش��������⣺
��1������A��ȼ���ȴ���ȼ�ϡ���֪AΪ������Ԫ�أ�����̬ԭ�����ʧȥ1��4���������������������ܣ������ʾ������ԭ�Ӻ�����������㣬���Ԫ��λ�����ڱ�______�壬д��Aȼ�պ��γɵ�������ĵ���ʽ��______��
I1 | I2 | I3 | I4 | �� | |
�����ܣ�kJ/mol�� | 738 | 1451 | 7733 | 10540 | �� |
��2����ͼ�dz�������Ԫ�������ڱ��еķֲ�������Ԫ�صĶ�����Ԫ����ԭ�Ӱ뾶������______����Ԫ�ط��ţ�����ԭ���������______���˶�״̬��ͬ�ĵ��ӣ�д��������������Ӧˮ������ˮ��Һ�еĵ��뷽��ʽ��______��
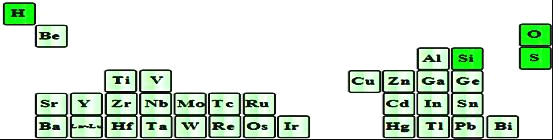
��3����������Ԫ����������ԭ�ӿ����γɵ���˷��ӣ��仯ѧ�������ͼ��Ƕ���ȣ���÷��ӵĿռ乹��Ϊ______��������Ϊ______���ӣ�ѡ����ԡ��Ǽ��ԡ�����
��4���������ڸ����»���ˮ������Ӧ����һ�ֺ�ɫ�����һ����ȼ�����壬��ÿ����1mol����ȼ����ų�37.68kJ��������д���˷�Ӧ���Ȼ�ѧ����ʽ��______��
��5��ȡ����Al��Mg�Ͻ���Ʒ�����ձ��У�����20mL 1mol/L��NaOH��Һ��ǡ����ȫ��Ӧ������������ȷ����______��ѡ���ţ���
a��Mg��������Al������
b�����������20mL 1mol/L�����ᣬ��ų������������ʵ�������2/3
c������NaOH�е�H����D��DΪ���⣩�����ɵ�������D��H���ʵ���֮��Ϊ1��2��
���𰸡���A ![]() Al 3 H++AlO2-+H2O
Al 3 H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH- �������� �Ǽ��� 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=��150.72kJ/mol b
Al3++3OH- �������� �Ǽ��� 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=��150.72kJ/mol b
��������
(1)���������ܵı仯�����ж�Ԫ�����࣬MgO�����ӻ������þ�����������ӹ��ɣ�
(2)����ԭ�Ӱ뾶�ı仯�����ж�ԭ�ӣ�ԭ�Ӻ���û���˶�״̬��ͬ�ĵ��ӣ�����������ˮ��Һ�д�����ʽ�������ʽ���룻
(3)����ԭ�ӵĹ��ɺͳɼ��ص������
(4)�������ڸ����»���ˮ������Ӧ����Fe3O4��H2����д����Ӧ����ʽ���ټ��㷴Ӧ�ȣ����д���Ȼ�ѧ����ʽ��
(5)a. Al������������Һ��Ӧ����Mg����Ӧ��b. ���ݷ�Ӧ����ʽ���㣻c. ����Al�����Һ��Ӧ�ı��ʷ�����
(1)��Ԫ�صĵ��������ܾ�����˵��������������Ϊ2�����ڵڢ�A�壬�Ҵ��ڵ������ڣ���ΪMgԪ�أ�����������ȼ������MgO����þ�����������ӹ��ɣ�����ʽΪ��![]() ���ʴ�Ϊ����A��
���ʴ�Ϊ����A��![]() ��
��
(2)ͬ����Ԫ�ص�ԭ���������ԭ�Ӱ뾶��С��һ����Ӳ���Խ��ԭ�Ӱ뾶Խ��ͼ�еĶ�����Ԫ����Al��ԭ�Ӱ뾶���ԭ�Ӻ���û���˶�״̬��ͬ�ĵ��ӣ��������3�����ӣ����������3���˶�״̬��ͬ�ĵ��ӣ�����������ˮ��Һ�д�����ʽ�������ʽ���룬���뷽��ʽΪ��H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-��
Al3++3OH-��
(3)��������Ԫ����������ԭ�ӿ����γɵ���˷��ӣ��仯ѧ�������ͼ��Ƕ���ȣ��÷���ΪSiH4��Ϊ�������幹�ͣ����ڷǼ��Է��ӣ��ʴ�Ϊ���������壻�Ǽ��ԣ�
(4)�������ڸ����»���ˮ������Ӧ����Fe3O4��H2��������Ӧ��3Fe+4H2O(g)![]() Fe3O4+4H2 ������4mol�����ų�����Ϊ37.68kJ��4=150.72kJ�����Ȼ�ѧ����ʽΪ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol���ʴ�Ϊ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol��
Fe3O4+4H2 ������4mol�����ų�����Ϊ37.68kJ��4=150.72kJ�����Ȼ�ѧ����ʽΪ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol���ʴ�Ϊ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol��
(5)a. Al������������Һ��Ӧ����Mg����Ӧ����AlΪ��������a����
b. NaOH���ʵ���Ϊ0.02L��1mol/L=0.02mol����2Al+2NaOH+2H2O=2NaAlO2+3H2����֪��AlΪ0.02mol����������Ϊ0.03mol�����������20mL 1mol/L�����ᣬþ���������ϡ���ᷴӦ��HClΪ0.02mol����2Al+6HCl=2AlCl3+3H2����֪HCl���㣬����Hԭ���غ��![]() �����Էų������������ʵ�������
�����Էų������������ʵ�������![]() ����b��ȷ��
����b��ȷ��
c. Al�����Һ��Ӧ�ı�����Al����ˮ��Ӧ���������������������������������������Ʒ�Ӧ��ƫ��������ˮ�������е���Ԫ������ˮ������������DԪ�أ���c����
�ʴ�Ϊ��b��

 ����5��2���ϵ�д�
����5��2���ϵ�д�����Ŀ������ͼ��ʾװ�÷ֱ����ʵ�飬��ش��������⣺
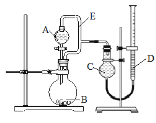
ʵ�� | A���Լ� | B���Լ� | C��Һ�� |
I | ����ʳ��ˮ | ��ʯ | H2O |
II | Ũ��ˮ | NaOH���� | CCl4 |
III | ���� | H2O | |
IV | NaOH��Һ | þ���Ͻ� | H2O |
��1������E�������ǣ�____________________��_________________��
��2��ʵ��I��ƿB�з�����Ӧ�Ļ�ѧ����ʽ��________�����������徭�鴿���ȼ��������___________��
��3��ʵ���ʣ���NH3�����մ��������¸���β������װ���У����ܷ�ֹ��������___________��

��4��ʵ��III��ʵ��Ŀ������֤�����ڳ�ʪ�����лᷢ��������ʴ����A���Լ���ѡ��__________������ţ�;
a NaOH��Һ b C2H5OH c NaCl��Һ d ϡ����
��֤�������ڳ�ʪ�����лᷢ��������ʴ��������_________;
��5��д��ʵ��IV�з�����Ӧ�����ӷ���ʽ_________��������ʱC��Һ�����D��Һ�棬������þ���Ͻ���þ������������_______������ƫ��������ƫ����������Ӱ��������
����Ŀ����������Ҫ��������ת����ͼ��ʾ��
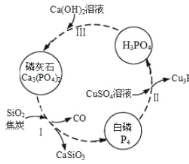
(1)����������մ��Ƥ���ϣ�����0.2mol/L CuSO4��Һ��ϴ�����ݲ������жϣ�1mol CuSO4���������İ������ʵ���Ϊ______��
(2)������У���Ӧ��ı�����ͬ�ɻ�ò�ͬ�IJ����Ca3(PO4)2����ܵIJ��ﻹ��______��
��ʯ�������ʵ�ԭ�ϣ�������ɿ��Կ�����Ca3(PO4)2��CaF2��CaSO4��CaCO3��SiO2�Ļ�������Ԫ�صķ���������£���Ԫ�ؾ�����������ʽ��ʾ����
�ɷ� | CaO | P2O5 | SO3 | CO2 |
����������%�� | 47.30 | 28.40 | 3.50 | 6.10 |
(3)��ʯ�У�̼Ԫ�ص���������Ϊ______%��������λС������
(4)ȡ100g��ʯ��ĩ������������Ũ���ᣬ�����ȣ���Ԫ��ȫ����CaSO4����ʽ���ڣ����Եõ�CaSO4______g��������λС������
(5)ȡm g ��ʯ��ĩ����50.00mL������Һ������Ϊ0.5mol/L������Ϊ0.1mol/L�����䷴Ӧ�����Ca��S��PԪ��ȫ����CaSO4��Ca(H2PO4)2����ʽ���ڣ���m��ֵ______��