题目内容
【题目】镁及其化合物在工业上有广泛的应用。
完成下列计算:
(1)称取某镁铝合金10g,放入100mL3mol/L的NaOH溶液中,完全反应收集到6.72L的H2(标准状况)。该合金中镁的质量分数为___。
(2)将镁条在空气中燃烧后的产物溶解在50mL1.6mol/L的盐酸中恰好完全反应,再加入过量NaOH把NH3全部蒸发出来,经测定NH3为0.102g,则镁条在空气中燃烧的产物及质量为___。
(3)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁。18.2g轻质碳酸镁样品经高温完全分解后得8.0g氧化镁固体,放出3.36L二氧化碳(标准状况),求轻质碳酸镁的化学式___。
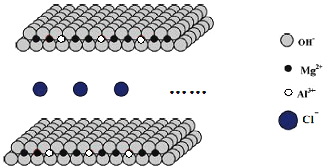
(4)氯离子插层的镁铝水滑石(Mg-Al-ClLDHs)是一种新型的阴离子交换材料。其结构示意图如图所示(每一层可视作平面无限延伸结构)。该离子交换原理是将插层离子与其它阴离子进行等电荷交换。取镁铝水滑石10.66g与0.02molNa2CO3发生完全交换,产物在高温下完全分解,得到金属氧化物和气体。将金属氧化物加入稀硝酸完全溶解后,再加入NaOH溶液直至过量,最终得到4.64g白色沉淀。求Mg-Al-ClLDHs的化学式___。
【答案】46% MgO 1.12g;Mg3N2 0.3g 3MgCO3Mg(OH)23H2O Mg2Al(OH)6Cl3H2O
【解析】
(1)发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式计算Al的质量,进而计算Mg的质量,再计算合金中Mg的质量分数;
(2)Mg条在空气中燃烧生成MgO与Mg3N2,根据氮原子守恒计算n(Mg3N2),进而计算m(Mg3N2),与盐酸反应生成氯化镁与氯化铵,根据氯离子守恒计算n(MgCl2),再根据Mg原子守恒计算n(MgO),进而计算m(MgO);
(3)18.2g轻质碳酸镁样品经高温完全分解后得8.0g 氧化镁固体,放出3.36L二氧化碳(标准状况),二氧化碳的质量为![]() ×44g/mol=6.6g,而8g+6.6g=14.6g<18.2g,故有水生成,则生成水的质量为18.2g-14.6g=3.6g,根据碳原子守恒计算n(CO32﹣),根据Mg原子守恒计算n(Mg2+),根据电荷守恒判断计算n(OH﹣),再根据H元素守恒判断计算n(H2O),进而确定其化学式;
×44g/mol=6.6g,而8g+6.6g=14.6g<18.2g,故有水生成,则生成水的质量为18.2g-14.6g=3.6g,根据碳原子守恒计算n(CO32﹣),根据Mg原子守恒计算n(Mg2+),根据电荷守恒判断计算n(OH﹣),再根据H元素守恒判断计算n(H2O),进而确定其化学式;
(4)氯离子插层的镁铝水滑石中氯离子与碳酸根离子交换,根据电荷守恒可以计算n(Cl﹣);完全交换产物在高温下完全分解,得到金属氧化物和气体,应是氧化镁、氧化铝与二氧化碳,将金属氧化物加入稀硝酸完全溶解后,再加入NaOH溶液直至过量,最终得到4.64g白色沉淀为Mg(OH)2,据此计算n(Mg2+),由结构示意图可知,Mg2+与Al3+的个数比为2:1,据此计算n(Al3+),再根据电荷守恒计算n(OH﹣),根据质量守恒判断计算n(H2O),进而确定Mg﹣Al﹣Cl LDHs的化学式。
(1)氢气的物质的量为![]() =0.3mol,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知Al的物质的量为0.2mol,Al的质量为0.2mol×27g/mol=5.4g,Mg的质量为10g-5.4g=4.6g,故合金中Mg的质量分数为
=0.3mol,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知Al的物质的量为0.2mol,Al的质量为0.2mol×27g/mol=5.4g,Mg的质量为10g-5.4g=4.6g,故合金中Mg的质量分数为![]() =46%。答案为:46%;
=46%。答案为:46%;
(2)Mg条在空气中燃烧生成MgO与Mg3N2,根据氮原子守恒n(Mg3N2)=![]() n(NH3)=
n(NH3)=![]() ×
×![]() =0.003mol,故m(Mg3N2)=0.003mol×100g/mol=0.3g,燃烧产物与盐酸反应生成氯化镁与氯化铵,根据氯离子守恒2n(MgCl2)+n(NH4Cl)=n(HCl),即2n(MgCl2)+
=0.003mol,故m(Mg3N2)=0.003mol×100g/mol=0.3g,燃烧产物与盐酸反应生成氯化镁与氯化铵,根据氯离子守恒2n(MgCl2)+n(NH4Cl)=n(HCl),即2n(MgCl2)+![]() =0.05L×1.6mol/L,则n(MgCl2)=0.037mol,根据Mg原子守恒n(MgO)+3n(Mg3N2)= n(MgCl2),故n(MgO)=0.037mol-0.003mol×3=0.028mol,故m(MgO)=0.028mol×40g/mol=1.12g。答案为:MgO 1.12g;Mg3N2 0.3g;
=0.05L×1.6mol/L,则n(MgCl2)=0.037mol,根据Mg原子守恒n(MgO)+3n(Mg3N2)= n(MgCl2),故n(MgO)=0.037mol-0.003mol×3=0.028mol,故m(MgO)=0.028mol×40g/mol=1.12g。答案为:MgO 1.12g;Mg3N2 0.3g;
(3)18.2g轻质碳酸镁样品经高温完全分解后得8.0g 氧化镁固体,放出3.36L二氧化碳(标准状况),二氧化碳的质量为![]() ×44g/mol=6.6g,而8g+6.6g=14.6g<18.2g,故有水生成,则生成水的质量为18.2g-14.6g=3.6g,放出CO2的物质的量为
×44g/mol=6.6g,而8g+6.6g=14.6g<18.2g,故有水生成,则生成水的质量为18.2g-14.6g=3.6g,放出CO2的物质的量为![]() =0.15 mol,则span>n(CO32﹣)=0.15 mol,由题意n(Mg2+)=n(MgO)=
=0.15 mol,则span>n(CO32﹣)=0.15 mol,由题意n(Mg2+)=n(MgO)=![]() =0.2 mol,
=0.2 mol,
由题意根据电荷守恒,得n(OH﹣)=2n(Mg2+)-2n(CO32﹣)=0.1mol,
则n(H2O)=(18.2g-0.1mol×24g/mol-0.15mol×60g/mol-0.1mol×17g/mol)÷18g/mol=0.15 mol,
故n(MgCO3):n[Mg(OH)2]:n(H2O)=0.15mol: (0.2mol-0.15mol):0.15mol=3:1:3,
可得出晶体的化学式为3MgCO3Mg(OH)23H2O。答案为:3MgCO3Mg(OH)23H2O;
(4)氯离子插层的镁铝水滑石中氯离子与碳酸根离子交换,根据电荷守恒n(Cl﹣)=2n(CO32﹣)=0.02mol×2=0.04mol,完全交换产物在高温下完全分解,得到金属氧化物和气体,应是氧化镁、氧化铝与二氧化碳,将金属氧化物加入稀硝酸完全溶解后,再加入NaOH溶液直至过量,最终得到4.64g白色沉淀为Mg(OH)2,则n(Mg2+)=n[Mg(OH)2]=![]() =0.08mol,由结构示意图可知,Mg2+与Al3+的个数比为2:1,n(Al3+)=
=0.08mol,由结构示意图可知,Mg2+与Al3+的个数比为2:1,n(Al3+)=![]() n(Mg2+)=0.04mol,根据电荷守恒n(OH﹣)=0.04mol×3+0.08mol×2-0.04mol×1=0.24mol,
n(Mg2+)=0.04mol,根据电荷守恒n(OH﹣)=0.04mol×3+0.08mol×2-0.04mol×1=0.24mol,
根据质量守恒则n(H2O)=(10.66g-0.04mol×27g/mol-0.08mol×24g/mol-0.04mol×35.5g/mol-0.24mol×17g/mol)÷18g/mol=0.12mol,故n(Al3+):n(Mg2+):n(OH﹣):n(Cl﹣):n(H2O)=0.04:0.08:0.24:0.04:0.12=1:2:6:1:3,故镁铝水滑石的化学式为Mg2Al(OH)6Cl3H2O,答案为:Mg2Al(OH)6Cl3H2O。

【题目】磷及部分重要化合物的相互转化如图所示。
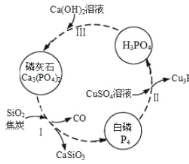
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)。
2CO2+N2+Q(Q>0)。
在某温度下测得该反应在不同时间的CO浓度如下表:
浓度(mol/L) 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)该反应平衡常数K的表达式为___;温度升高,K值___(选填“增大”“减小”“不变”);前2s的平均反应速率v(N2)=___;若上诉反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是___。
(2)工业合成氨的反应温度选择500℃左右的原因是___。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___。
A.N2、H2、NH3的浓度之比为1:3:2
B.容器内的压强保持不变
C.N2、H2、NH3的浓度不在变化
D.反应停止,正、逆反应的速率都等于零
(4)常温下向1molHCl的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是___;在通入NH3的过程中溶液的导电能力___(选填“变大”“变小”“几乎不变”)
【题目】下列对有关微粒的相互关系和特征描述正确的是( )
选项 | 微粒 | 相互关系 | 特征描述 |
A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A. A B. B C. C D. D