题目内容
19.用系统命法写出下列物质名称(1)
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷(2)
 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯(3)
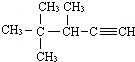 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔.(4)键线式
 表示的分子式C5H12;名称是2-甲基丁烷.
表示的分子式C5H12;名称是2-甲基丁烷.(5)丙基的2个结构简式分别为CH3CH2CH2-、-CH(CH3)2.
(6)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、温度计、冷凝管、尾接管、锥形瓶.
(7)戊烷(C5H12)的某种同分异构体只有一种一氯代物,试书写它的结构简式.C(CH3)4.
分析 (1)烷烃在命名时,要选择最长的碳链为主链,从离支链近的一端开始编号;
(2)烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端开始编号,用官能团两端编号较小的碳原子表示出双键的位置;
(3)炔烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端开始编号,用官能团两端编号较小的碳原子表示出三键的位置;
(4)在键线式中,端点和拐点均代表碳原子,根据每个碳原子要形成4条价键来确定所连的氢原子个数;烷烃在命名时,要选择最长的碳链为主链,从离支链近的一端开始编号;
(5)根据丙基即丙烷失去1个氢原子所形成的来分析;
(6)根据蒸馏装置来分析;
(7)同分异构体只有一种一氯代物,则只有一种H;
解答 解:(1)烷烃在命名时,要选择最长的碳链为主链,故主链上有7个氢原子,称为庚烷;从离支链近的一端开始编号,当两端离支链一样近时,要从支链多的一端开始编号,即在3号碳上有2个甲基,在5号碳上有1个甲基,故名称为:3,3,5-三甲基庚烷,故答案为:3,3,5-三甲基庚烷;
(2)烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,称为丁烯;从离官能团近的一端开始编号,用官能团两端编号较小的碳原子表示出双键的位置,故此烯烃的名称为:2,3-二甲基-1-丁烯,故答案为:2,3-二甲基-1-丁烯;
(3)炔烃命名时,要选含官能团的最长的碳链为主链,故主链上有5个碳原子,称为戊炔;从离官能团近的一端开始编号,用官能团两端编号较小的碳原子表示出三键的位置,故此炔的名称为:3,4,4-三甲基-1-戊炔,故名称为:3,4,4-三甲基-1-戊炔;
(4)在键线式中,端点和拐点均代表碳原子,主链含4个C,甲基在2号C上,共有5个C,为烷烃,其分子式为C5H12;烷烃在命名时,要选择最长的碳链为主链,从离支链近的一端开始编号,故名称为:2-甲基丁烷;故答案为:C5H12,2-甲基丁烷;
(5)丙基即丙烷失去1个氢原子所形成的,由于丙烷中的氢原子为2种,故丙基的结构简式为CH3CH2CH2-和-CH(CH3)2,故答案为:CH3CH2CH2-;-CH(CH3)2;
(6)根据蒸馏装置可知,所需的玻璃仪器有酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶等,故答案为:温度计,冷凝管;
(7)戊烷的同分异构体有三种,分别为正戊烷、异戊烷和新戊烷,其中新戊烷中氢原子位置都相同,其一氯代物只有一种,新戊烷的结构简式为C(CH3)4,
故答案为:C(CH3)4.
点评 本题考查较综合,涉及有机物的结构简式、分子式、命名及同分异构体,为高频考点,把握官能团与性质的关系为解答的关键,同分异构体为解答难点,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 8种 | B. | 16种 | C. | 32种 | D. | 64种 |
| A. | 反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| B. | 2 mol水的总能量高于2 mol氢气和1 mol氧气的总能量 | |
| C. | 断裂2 molH-H键和断裂1 molO═O键吸收的总能量低于形成4 molH-O键放出的总能量 | |
| D. | 断裂4 molH-O键吸收的总能量高于形成2 molH-H键和形成1 molO═O键放出的总能量 |
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体 |
| A. | 晶体中阴、阳离子的数目之比一定是1:1 | |
| B. | 晶体内一定只有离子键没有共价键 | |
| C. | 两元素可以在同一周期也可在不同周期 | |
| D. | 阴离子的电子数一定小于阳离子的电子数 |
| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |
| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |