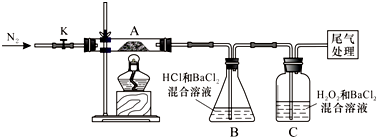
题目内容
9.根据元素周期表和元素周期律,下列推断正确的是( )| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |
分析 A、元素的非金属性越强,其对应最高价氧化物的水化物越强,非含氧酸不能由此确定;
B、过渡元素中Mn的最高价可以为+7价,处于VIIB族;
C、处于金属与非金属交界的元素可以作半导体材料;
D、具有相同电子层结构的微粒,原子序数越小,离子半径越大.
解答 解:A、元素的非金属性越强,其对应最高价氧化物的水化物越强,非含氧酸不能由此确定,非金属性越强,结合H的能力越强,越难电离,故A错误;
B、过渡元素中Mn的最高价可以为+7价,比如高锰酸钾中Mn化合价为+7,处于VIIB族,故B错误;
C、处于金属与非金属交界的元素可以作半导体材料,硅和锗均处于此位置,故C正确;
D、具有相同电子层结构的微粒,原子序数越小,对应离子的半径越大,但是电子层数越多,对应原子的半径越大,比如离子半径:O2->Na+,但是原子半径:Na>O,故D错误,
故选C.
点评 本题主要考查的是同学们对于元素周期表的认识以及对元素周期律的灵活应用,有一定难度,注意离子半径与原子半径的大小比较是关键.

练习册系列答案
相关题目
20.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 将0.1 mol•L-1氨水稀释成0.01 mol•L-1,测得 pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于 饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体 通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 一种烃在足量的氧气中燃烧并通过碱石灰减少的体积就是生成水蒸气的体积 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积改变(温度25℃),若体积减少,则y>4,否则y<4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高 |
18.有下列结论中正确的是( )
①微粒半径:Cl>S>P
②氢化物的稳定性:HF>HCl>HBr
③离子的还原性:Cl->Br->I-
④氧化性:S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>Br.
①微粒半径:Cl>S>P
②氢化物的稳定性:HF>HCl>HBr
③离子的还原性:Cl->Br->I-
④氧化性:S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>Br.
| A. | ②④⑥ | B. | ①③④ | C. | ①②⑤ | D. | ②⑤⑥ |
19.四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯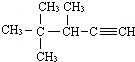 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔. 表示的分子式C5H12;名称是2-甲基丁烷.
表示的分子式C5H12;名称是2-甲基丁烷.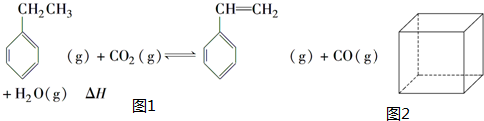
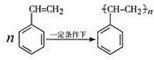 .立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).
.立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).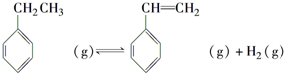 △H1=+117.6kJ•mol-1
△H1=+117.6kJ•mol-1