题目内容
8.取1 mol A和a mol B使其发生反应 A(g)+aB(g)?bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,则a、b可能是( )| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |
分析 依据化学平衡三段式列式计算分析判断,密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到ab的取值;
X(g)+a Y(g)?b Z(g)
起始量(mol) 1 a 0
变化量(mol) 0,5 0.5a 0.5b
平衡量(mol) 0.5 0.5a 0.5b
依据在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比得到,在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,即反应后气体物质的量是反应前气体物质的量$\frac{3}{4}$,则(0.5+0.5a+0.5b):(1+a)=3:4,讨论选项中ab的取值判断.
解答 解:1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)?b Z(g).反应达到平衡后,测得X的转化率为50%.而且,在同温同压下反应前后混合气体的密度之比和气体体积成反比,即密度和气体物质的量成反比.
X(g)+a Y(g)?b Z(g)
起始量(mol) 1 a 0
变化量(mol) 0.5 0.5a 0.5b
平衡量(mol) 0.5 0.5a 0.5b
在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,在同温同压下测得反应前混合气体的密度与反应后混合气体密度比为4:3,即反应后气体物质的量是反应前气体物质的量$\frac{3}{4}$,则(0.5+0.5a+0.5b):(1+a)=3:4,
解得2b=a+1,
选项中只有a=3,b=2符合计算关系,
故选D.
点评 本题考查了化学平衡的计算应用,混合气体密度之比在相同条件下和气体物质的量成反比是应用的主要计算依据,题目难度中等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | R原子的最外层上有4个电子 | |
| B. | RO3n-中的R只能被还原 | |
| C. | HnRO3一定是强酸 | |
| D. | R的单质既具有氧化性又具有还原性 |
| 选项 | 第I栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2溶液 | NaHCO3溶液滴入NaOH溶液 | OH-+HCO3-═CO32-+H2O |
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-═HCO3- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 碳氢键的键能相等 | B. | 甲烷的二氯代物的结构只一种 | ||
| C. | 四个碳氢键的键长相等 | D. | 甲烷的一氯代物只有一种 |
| 序号 | 操作及现象 | 结论 |
| A | 将0.1 mol•L-1氨水稀释成0.01 mol•L-1,测得 pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于 饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体 通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯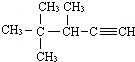 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔. 表示的分子式C5H12;名称是2-甲基丁烷.
表示的分子式C5H12;名称是2-甲基丁烷.
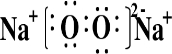 .
.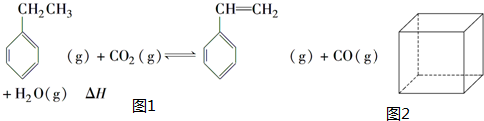
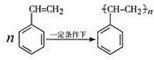 .立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).
.立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).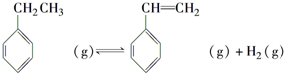 △H1=+117.6kJ•mol-1
△H1=+117.6kJ•mol-1