题目内容
14.下列说法中,正确的是( )| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体 |
分析 A.地沟油主要成分为油脂,油脂在碱性条件下水解生成肥皂;
B.硅晶体是半导体材料,二氧化硅用于制造光导纤维;
C.二氧化碳不会造成酸雨;
D.胶粒直径为10-7~10-9m的分散系属于胶体.
解答 解:A.地沟油主要成分为油脂,油脂在碱性条件下水解生成肥皂,故A正确;
B.硅晶体是半导体材料,二氧化硅用于制造光导纤维,故B错误;
C.二氧化碳不会造成酸雨,故C错误;
D.胶粒直径为10-7~10-9m的分散系属于胶体,2.55μm的颗粒物直径为2.5×10-6,大于胶体粒子直径,不属于胶体,故D错误.
故选A.
点评 本题考查了化学与生活的关系,较基础.注意胶体分散系中胶粒直径为:为10-7~10-9m.

练习册系列答案
相关题目
5.对下列实验现象的分析,结论正确的是( )
| 操 作 | 实验现象 | 结 论 | |
| A | 某溶液中加入氯化钡、稀硝酸的 混合液 | 产生白色沉淀 | 该溶液中一定含有SO42-或SO32- |
| B | 取某溶液进行焰色反应 | 焰色呈黄色 | 该溶液一定是某钠盐的溶液 |
| C | 把湿润的碘化钾-淀粉试纸放入红棕色的气体中 | 试纸变蓝色 | 气体可能是NO2 |
| D | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液 | 溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| A. | A | B. | B | C. | C | D. | D |
9.下列选项属于碳链异构的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2═C(CH3)2和CH3CH═CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2CH2COOH和CH3COOCH2CH3 |
6.用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
 .
.
 .
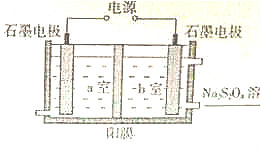
.
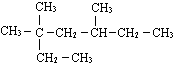 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷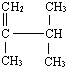 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯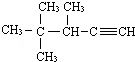 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔.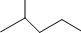 表示的分子式C5H12;名称是2-甲基丁烷.
表示的分子式C5H12;名称是2-甲基丁烷.
 .
.