题目内容
4.由两种短周期元素构成的某常见离子化合物,阴、阳离子所含的电子数不同,关于该离子化合物的下列说法正确的是( )| A. | 晶体中阴、阳离子的数目之比一定是1:1 | |
| B. | 晶体内一定只有离子键没有共价键 | |
| C. | 两元素可以在同一周期也可在不同周期 | |
| D. | 阴离子的电子数一定小于阳离子的电子数 |
分析 A、离子晶体氯化镁,阴、阳离子所含的电子数分别是18、10,而晶体中阴、阳离子的数目之比一定是2:1;
B、在离子晶体过氧化钠中,阴、阳离子分别为过氧根离子和钠离子,电子数分别为:18和10,但晶体中含有氧氧非极性键;
C、离子晶体氯化镁,阴、阳离子所含的电子数分别是18、10;而离子晶体NaH中,阴、阳离子的电子数分别为:2和10;
D、离子晶体氯化镁,阴、阳离子所含的电子数分别是18、10,阴离子的电子数大于阳离子的电子数.
解答 解:A、离子晶体氯化镁,阴、阳离子所含的电子数分别是18、10,而晶体中阴、阳离子的数目之比一定是2:1,而不是一定为1:1,故A错误;
B、在离子晶体过氧化钠中,阴、阳离子分别为过氧根离子和钠离子,电子数分别为:18和10,但晶体中含有氧氧非极性键,所以一定含有离子键,可能含有共价键,故B错误;
C、离子晶体氯化镁,阴、阳离子所含的电子数分别是18、10,镁和氯元素在同一周期;而离子晶体NaH中,阴、阳离子分别为氢离子和钠离子,电子数分别为2和10,但钠与H元素不在同一周期,所以两元素可以在同一周期也可在不同周期,故C正确;
D、离子晶体氯化镁,阴、阳离子所含的电子数分别是18、10,阴离子的电子数大于阳离子的电子数,故D错误;
故选C.
点评 本题考查离子结构、物质结构等知识,难度中等,本题采取列举法解答,找出例外举例.列举法在元素周期表中经常利用.

练习册系列答案
相关题目
9.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
(1)通过分析 x 值变化规律,确定N、Mg的 x 值范围:
2.55<x (N)<3.44,0.93<x (Mg)<1.57.
(2)某有机化合物结构中含S-N键,其共用电子对偏向氮(写原子名称).
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键类型是共价键.
(4)预测周期表中,x值最小的元素位于六周期IA族.(放射性元素除外)
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x 值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
2.55<x (N)<3.44,0.93<x (Mg)<1.57.
(2)某有机化合物结构中含S-N键,其共用电子对偏向氮(写原子名称).
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键类型是共价键.
(4)预测周期表中,x值最小的元素位于六周期IA族.(放射性元素除外)
16.下表所列各组第I栏中的化学反应与第Ⅱ栏中的化学反应都可以用第Ⅲ栏中的离子方程式表示的是( )
| 选项 | 第I栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2溶液 | NaHCO3溶液滴入NaOH溶液 | OH-+HCO3-═CO32-+H2O |
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-═HCO3- |
| A. | A | B. | B | C. | C | D. | D |
13.能够证明甲烷分子空间结构为正四面体的事实是( )
| A. | 碳氢键的键能相等 | B. | 甲烷的二氯代物的结构只一种 | ||
| C. | 四个碳氢键的键长相等 | D. | 甲烷的一氯代物只有一种 |
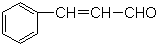
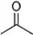 ,根据键线式回答下列问题:
,根据键线式回答下列问题: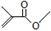 分子式:C5H9O2,结构简式:CH2=CH(CH3)COOCH3.
分子式:C5H9O2,结构简式:CH2=CH(CH3)COOCH3. .
. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.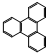 的一氯取代物有2种,
的一氯取代物有2种, 的二氯取代物有7种.
的二氯取代物有7种.
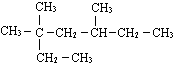 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷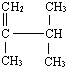 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯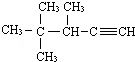 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔.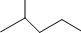 表示的分子式C5H12;名称是2-甲基丁烷.
表示的分子式C5H12;名称是2-甲基丁烷.