题目内容
8.下列说法中正确的是( )| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
分析 A.电解质溶液导电性与离子浓度成正比;
B.硫酸是强电解质,在水溶液中完全电离;
C.液态氯化氢中只含HCl分子;
D.电解质溶液中存在溶剂分子,也可能存在溶质分子.
解答 解:A.电解质溶液导电性与离子浓度成正比,与电解质强弱无关,故A错误;
B.硫酸是强电解质,在水溶液中完全电离,所以稀硫酸溶液中不存在硫酸分子,故B正确;
C.液态氯化氢中只含HCl分子,所以液态氯化氢不导电,故C错误;
D.电解质溶液中存在溶剂分子,也可能存在溶质分子,强电解质溶液中存在溶剂分子,弱电解质水溶液中存在溶剂分子和溶质分子,故D错误;
故选B.
点评 本题考查溶液导电性、强弱电解质等知识点,明确电解质溶液导电性原理及强弱电解质的关系是解本题关键,注意溶液导电性与电解质强弱无关,易错选项是D,很多同学往往漏掉溶剂而导致错误.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列有关化学用语表示正确的是( )
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: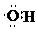 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
3.工业上用软锰矿和闪锌矿联合生产MnO2和Zn的化学方程式为:
①MnO2+ZnS+2H2SO4$\frac{\underline{\;电解\;}}{\;}$MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4.
下列说法中错误的是( )
①MnO2+ZnS+2H2SO4$\frac{\underline{\;电解\;}}{\;}$MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4.
下列说法中错误的是( )
| A. | 反应①中MnO2和H2SO4都是氧化剂 | |
| B. | 反应①中每析出12.8g S沉淀,转移0.8mol电子 | |
| C. | 金属锌也可用热还原法制备 | |
| D. | 硫酸在生产种可循环使用 |
20.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 冶炼铬可采用铝热法 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
1.短周期元素A、B、C、D的原子序数依次递增,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,D元素原子最外层电子数为电子层数的2倍,四种元素原子的核电荷数之和为36.则下列叙述正确的是( )
| A. | C元素的单质在B元素的单质中燃烧,产物1mol与足量的水反应转移电子数为NA | |
| B. | 由上述元素形成的化合物只有一种具有漂白性 | |
| C. | B、C、D三种元素形成的化合物的水溶液用惰性电极电解时,溶液pH一定不变 | |
| D. | A、B形成化合物的沸点高于A、C形成化合物的沸点,因为前者分子间形成了氢键 |
2.下列实验操作与预期实验目的或实验结论不一致的是
( )
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 在0.1mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 验证盐类水解反应是吸热反应 |
| C | 将一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 | 得到NaCl晶体 |
| D | 亚硫酸钡固体加入盐酸,有二氧化硫气体生成 | 盐酸的酸性强于亚硫酸 |
| A. | A | B. | B | C. | C | D. | D |
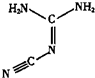 双氰胺结构简式如图.
双氰胺结构简式如图.