题目内容
2.下列实验操作与预期实验目的或实验结论不一致的是| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 在0.1mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 验证盐类水解反应是吸热反应 |
| C | 将一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 | 得到NaCl晶体 |
| D | 亚硫酸钡固体加入盐酸,有二氧化硫气体生成 | 盐酸的酸性强于亚硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,硝酸根离子具有氧化性;
B.盐类水解是吸热反应,升高温度促进水解;
C.硝酸钠随着温度变化其溶解度变化较大,氯化钠随着温度变化其溶解度变化不大;
D.强酸能和弱酸盐反应生成弱酸.
解答 解:A.溶液混合后,酸性条件下,硝酸根离子也具有氧化性,对实验造成干扰,故A错误;
B.升高温度,溶液颜色加深,说明溶液碱性增强,说明平衡向水解反应方向移动,则盐类水解是吸热反应,故B正确;
C.利用温度对不同物质溶解度影响的差异蒸发结晶分离物质,硝酸钠随着温度变化其溶解度变化较大,氯化钠随着温度变化其溶解度变化不大,所以可以得到氯化钠晶体,故C正确;
D.体现了强酸与弱酸盐反应生成强酸盐和弱酸的反应原理,故D正确;
故选A.
点评 本题考查化学实验方案设计,涉及氧化还原、盐类水解、结晶和相对强的酸与弱酸盐反应等知识,根据氧化性强弱顺序、盐类水解特点、酸的强弱等知识点来分析解答,易错选项是A,题目难度中等.

练习册系列答案
相关题目
8.下列说法中正确的是( )
| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
13.下列有关实验的操作、原理和现象的叙述正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 向淀粉溶液中加入稀硫酸,加热几分钟后冷却,再加入新制的Cu(OH)2悬浊液,加热,没有砖红色沉淀生成,证明淀粉没有水解成葡萄糖 | |
| D. | 用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 |
17.甲~辛等元素在元素周期表中的相对位置如下表所示,已知甲是IA族元素,乙与己同周期,己单质在暗处与H2剧烈化合并发生爆炸.下列判断正确的是:( )


| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
7.在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论.下列“推理”正确的是( )
| A. | 较强酸可以制取较弱酸,推出H2S不能制取H2SO4 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4 | |
| C. | 电解氯化铜溶液可得到Cu;则电解食盐水可以得到Na | |
| D. | 1mol O2和Mg完全反应获得4mol电子;则1mo1 O2和其他金属完全反应都获得4mol电子 |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | pH=1的溶液中:K+、Fe2+、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- | |
| D. | 与铝反应生成氢气的溶液中:NH${\;}_{4}^{+}$、K+、Cl-、SO${\;}_{4}^{2-}$ |
11.下列实验操作中,说法正确的是( )
| A. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解Na2SO4溶液,一段时间后切断电源,在两极之间接上发光二极管,发现二极管发光 | |
| B. | 滴定管、移液管以及滴定过程中用于盛待测液的锥形瓶,使用前都需要洗涤与润洗 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 |
12.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知摩尔盐在隔绝空气的条件下加热至500°C时可完全分解.根据所学知识和有关原理分析,其分解产物肯定不正确的是( )
| A. | Fe2O3 SO2 NH3 H2O | B. | FeO SO3 NH3 H2O | ||
| C. | Fe2O3 SO2 SO3NH3 H2O | D. | FeO SO2 NH3 H2O |
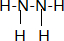 其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)
其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)