题目内容
18.下列有关化学用语表示正确的是( )| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: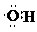 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
分析 A.次氯酸的中心原子是氧原子,根据成键情况来书写结构式;
B.多元弱酸的酸式根离子不能拆;
C.羟基是电中性的原子团,氧原子周围多1个电子;
D.异丙醇的结构简式:CH3CH(OH)CH3.
解答 解:A.次氯酸的中心原子是氧原子,结构式为H-O-Cl,故A错误;
B.NaHCO3在水中的电离方程式,离子方程式:NaHCO3=Na++HCO3-,故B错误;
C.羟基是电中性的原子团,氧原子周围多1个电子,羟基电子式为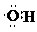
D.异丙醇的结构简式:CH3CH(OH)CH3,故D错误;
故选:C.
点评 本题考查了化学用语的使用,熟悉电子式、结构简式、电离方程式书写方法即可解答,题目难度不大.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
8.下列关于有机化合物1和2的说法中,正确的是( )
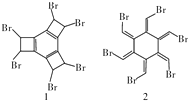

| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| B. | 10 mL 0.1 mol•L-1CH3COONa溶液与6 mL 0.2 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |
10.下列关于“反应先后顺序”的评价中正确的是( )
| A. | 向CuSO4溶液中滴加氨水,先生成深蓝色溶液,后生成蓝色沉淀 | |
| B. | 向NH4Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| C. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 | |
| D. | 足量锌与浓硫酸反应,先产生二氧化硫,后产生氢气 |
7.下列有关化学的基本概念、规律和原理正确的是( )
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
8.下列说法中正确的是( )
| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
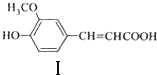 的说法,正确的是AB.
的说法,正确的是AB.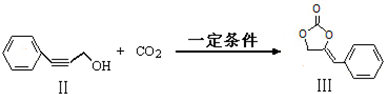
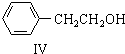 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$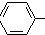 CH2CH2
CH2CH2 -CH2CH3+H2O
-CH2CH3+H2O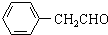 ;
;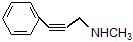 也可以和CO2发生类似反应①的反应,生成由VI,VI的结构简式为
也可以和CO2发生类似反应①的反应,生成由VI,VI的结构简式为 .
. .
.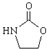 ,涉及的反应方程式为HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$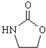 +H2O.
+H2O. .
.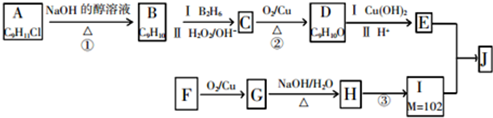
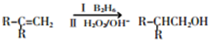
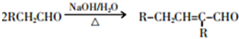
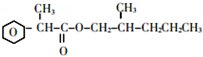 .
.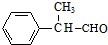 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$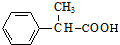 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.