题目内容
3.工业上用软锰矿和闪锌矿联合生产MnO2和Zn的化学方程式为:①MnO2+ZnS+2H2SO4$\frac{\underline{\;电解\;}}{\;}$MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4.
下列说法中错误的是( )
| A. | 反应①中MnO2和H2SO4都是氧化剂 | |
| B. | 反应①中每析出12.8g S沉淀,转移0.8mol电子 | |
| C. | 金属锌也可用热还原法制备 | |
| D. | 硫酸在生产种可循环使用 |
分析 A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变;
B.反应中S元素由-2价升高为0;
C.在加热条件下ZnO可以被还原剂还原;
D.由①②可知,硫酸既参加反应,又从反应中生成.
解答 解:A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变,则步骤(1)中MnO2是氧化剂,H2SO4是反应物,故A错误;
B.反应中S元素由-2价升高为0,则每析出12.8gS沉淀共转移$\frac{12.8g}{32g/mol}$×(2-0)=0.8mol电子,故B正确;
C.在加热条件下ZnO可以被还原剂还原,则金属锌也可用热还原法制备,故C正确;
D.由①②可知,硫酸既参加反应,又从反应中生成,所以硫酸在生产中可循环使用,故D正确;
故选A.
点评 本题考查金属的冶炼和氧化还原反应,明确元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列实验操作和现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测量等浓度的Na2CO3与C6H5ONa溶液的pH | Na2CO3溶液的pH大于C6H5ONa的pH | H2CO3的酸性大于C6H5OH |
| B | 将SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 取少量的变质FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | FeCl2未完全变质 |
| D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法中正确的是( )
| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
17.甲~辛等元素在元素周期表中的相对位置如下表所示,已知甲是IA族元素,乙与己同周期,己单质在暗处与H2剧烈化合并发生爆炸.下列判断正确的是:( )


| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
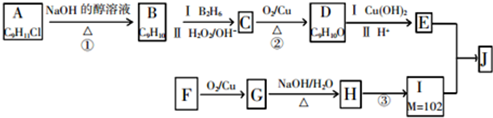
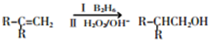
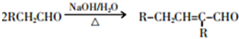
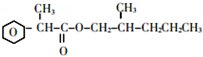 .
.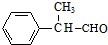 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$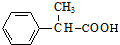 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.
 .
.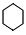
 :
:
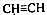 和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.
和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.