题目内容
20.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )| A. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 冶炼铬可采用铝热法 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
分析 A、轻质油满足不了生产生活的需求,石油裂化可得到更多的轻质油;
B、根据煤的气化和液化的概念分析;
C、含元素的化合价变化,为氧化还原反应;不存在元素的化合价变化的反应,不属于氧化还原反应,以此来解答.
D、溴离子发生氧化反应生成溴单质,然后鼓入热空气或水蒸气提取海水中的溴.
解答 解:A、裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,故A正确;
B、煤的气化是煤与水蒸汽反应H2、CO等气体的过程.煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,两种过程都生成了新物质,是化学变化,故B错误;
C、金属铝能把金属钒从氧化物中置换出来,即冶炼金属钒可以用铝热法,故C正确;
D、溴离子发生氧化反应生成溴单质,离子反应方程式为Cl2+2Br-=Br2+2Cl-,溴具有挥发性,然后鼓入热空气或水蒸气提取海水中的溴,故D正确;
故选B.
点评 本题考查较综合,涉及溴的制取、煤的综合利用等知识点,明确物质的性质是解本题关键,注意煤的液化和气化的区别,题目难度不大.

练习册系列答案
相关题目
10.下列关于“反应先后顺序”的评价中正确的是( )
| A. | 向CuSO4溶液中滴加氨水,先生成深蓝色溶液,后生成蓝色沉淀 | |
| B. | 向NH4Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| C. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 | |
| D. | 足量锌与浓硫酸反应,先产生二氧化硫,后产生氢气 |
8.下列说法中正确的是( )
| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
5.吸收能量的反应一定是( )
| A. | 贮存能量 | B. | 释放能量 | ||
| C. | 生成物稳定性大于反应物的稳定性 | D. | 原子得到电子的反应 |
13.下列有关实验的操作、原理和现象的叙述正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 向淀粉溶液中加入稀硫酸,加热几分钟后冷却,再加入新制的Cu(OH)2悬浊液,加热,没有砖红色沉淀生成,证明淀粉没有水解成葡萄糖 | |
| D. | 用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | pH=1的溶液中:K+、Fe2+、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- | |
| D. | 与铝反应生成氢气的溶液中:NH${\;}_{4}^{+}$、K+、Cl-、SO${\;}_{4}^{2-}$ |
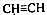 和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.
和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.