题目内容
13.燃烧法是测定有机化合物分子式的一种重要方法,请回答下列问题:完全燃烧2.24L(标准状况下)某烃后,测得生成二氧化碳17.6g,生成水9.0g,则2.24L(标准状况下)该烃中,含碳的质量为4.8g,含氢的质量为1g,B的分子式为C4H10,它可能的结构简式是CH3CH2CH2CH3和CH(CH3)3.
分析 根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,由二氧化碳的质量,可求得烃中C原子个数,有机物中的氢全部转化为水,由水的其质量可以可求得烃中H原子个数,以此可求得烃的分子式;根据碳链异构来书写同分异构体.
解答 解:二氧化碳为体积为17.6g,n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,n(C)=n(CO2)=0.4mol,则m(C)=nM=0.4mol×12g/mol=4.8g;
水的质量为9.0g,n(H2O)=$\frac{9.0g}{18g/mol}$=0.5mol,n(H)=2n(H2O)=2×0.5mol=1mol,所以m(H)=1g,
即0.1mol烃中含有0.4molC原子,1molH原子,所以该烃分子中C原子个数为4,H原子个数为10,
所以该烃的分子式为C4H10,
根据碳链异构可得C4H10的结构简式为:CH3CH2CH2CH3、CH(CH3)3,
故答案为:4.8;1;C4H10;CH3CH2CH2CH3、CH3CH(CH3)2.
点评 本题考查根据燃烧法确定有机物分子组成的知识,根据原子守恒法来解答,难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| B. | 10 mL 0.1 mol•L-1CH3COONa溶液与6 mL 0.2 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |
4.有关化学用语的表示正确的是( )
| A. | 甲烷分子的比例模型是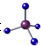 | B. | 二氧化碳的电子式: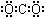 | ||
| C. | HClO的结构式为H-O-Cl | D. | 中子数为17的氯原子:${\;}_{17}^{37}$Cl |
1.下列实验操作正确的是( )
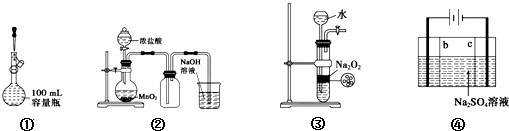

| A. | 装置①定容 | |
| B. | 装置②实验室制氯气 | |
| C. | 装置③用于制备少量氧气 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
8.下列说法中正确的是( )
| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
18.已知0.1mol•L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na2A、NaHA两溶液中,离子种类相同 | |
| B. | 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等 | |
| C. | NaHA溶液pH一定大于7 | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
5.吸收能量的反应一定是( )
| A. | 贮存能量 | B. | 释放能量 | ||
| C. | 生成物稳定性大于反应物的稳定性 | D. | 原子得到电子的反应 |
6.下列说法中正确的是( )
| A. | 实验室制乙炔时用启普发生器得到的气体再用硫酸铜溶液除杂即可得到纯净的乙炔 | |
| B. | 实验室制得的乙炔气体直接通入酸性高锰酸钾溶液后,若紫色褪去则能证明乙炔中含有不饱和键可以被氧化剂氧化 | |
| C. | 芳香烃即可从石油的催化重整得到,也可从煤中直接分离得到 | |
| D. | 通过石油分馏得到的脂肪烃依然是混合物 |
7.在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论.下列“推理”正确的是( )
| A. | 较强酸可以制取较弱酸,推出H2S不能制取H2SO4 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4 | |
| C. | 电解氯化铜溶液可得到Cu;则电解食盐水可以得到Na | |
| D. | 1mol O2和Mg完全反应获得4mol电子;则1mo1 O2和其他金属完全反应都获得4mol电子 |