题目内容
1.短周期元素A、B、C、D的原子序数依次递增,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,D元素原子最外层电子数为电子层数的2倍,四种元素原子的核电荷数之和为36.则下列叙述正确的是( )| A. | C元素的单质在B元素的单质中燃烧,产物1mol与足量的水反应转移电子数为NA | |
| B. | 由上述元素形成的化合物只有一种具有漂白性 | |
| C. | B、C、D三种元素形成的化合物的水溶液用惰性电极电解时,溶液pH一定不变 | |
| D. | A、B形成化合物的沸点高于A、C形成化合物的沸点,因为前者分子间形成了氢键 |
分析 短周期元素A、B、C、D的原子序数依次递增,B与D同主族,B的原子序数大于A,故B处于第二周期,D处于第三周期,D元素原子最外层电子数为电子层数的2倍,则D为S元素,B为O元素,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,即A、C处于IA族,二者核电荷数之和为36-8-16=12,故A为H元素,C为Na,据此解答.
解答 解:短周期元素A、B、C、D的原子序数依次递增,B与D同主族,B的原子序数大于A,故B处于第二周期,D处于第三周期,D元素原子最外层电子数为电子层数的2倍,则D为S元素,B为O元素,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,即A、C处于IA族,二者核电荷数之和为6-8-16=12,故A为H元素,C为Na.
A.Na在氧气燃烧生成Na2O2,与水发生反应:2Na2O2+2H2O=4NaOH+O2,反应中过氧化钠起氧化剂、还原剂作用,各占一半,1mol过氧化钠反应转移电子为1mol×$\frac{1}{2}$×2×[0-(-1)]=1mol,即转移电子数数为NA,故A正确;
B.上述元素形成的过氧化钠、二氧化硫等具有漂白性,故B错误;
C.B、C、D三种元素形成的化合物为硫酸钠或亚硫酸钠,亚硫酸钠溶液呈碱性,用惰性电极电解时,溶液pH发生变化,故C错误;
D.A、B形成化合物为水等,A、C形成化合物为NaH,前者分子晶体,后者属于离子晶体,NaH的沸点较高,故D错误,
故选:A.
点评 本题考查位置结构性质的关系,根据B的原子序数大于A、三种元素位置的关系,明确元素B为第二周期元素是解答本题的关键,题目难度中等.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
| A. | 强电解质溶液总比弱电解质的导电性强 | |
| B. | 稀硫酸溶液中不存在H2SO4分子 | |
| C. | 氯化氢是电解质,所以液态氯化氢能导电 | |
| D. | 电解质溶液中只存在离子,没有分子 |
| A. | 贮存能量 | B. | 释放能量 | ||
| C. | 生成物稳定性大于反应物的稳定性 | D. | 原子得到电子的反应 |
| A. | 实验室制乙炔时用启普发生器得到的气体再用硫酸铜溶液除杂即可得到纯净的乙炔 | |
| B. | 实验室制得的乙炔气体直接通入酸性高锰酸钾溶液后,若紫色褪去则能证明乙炔中含有不饱和键可以被氧化剂氧化 | |
| C. | 芳香烃即可从石油的催化重整得到,也可从煤中直接分离得到 | |
| D. | 通过石油分馏得到的脂肪烃依然是混合物 |
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 向淀粉溶液中加入稀硫酸,加热几分钟后冷却,再加入新制的Cu(OH)2悬浊液,加热,没有砖红色沉淀生成,证明淀粉没有水解成葡萄糖 | |
| D. | 用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 |
| A. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解Na2SO4溶液,一段时间后切断电源,在两极之间接上发光二极管,发现二极管发光 | |
| B. | 滴定管、移液管以及滴定过程中用于盛待测液的锥形瓶,使用前都需要洗涤与润洗 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 |
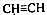 和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.
和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.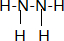 其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)
其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)