题目内容
8.铜与稀硝酸反应方程式为:Cu+HNO3=Cu(NO3)2+NO↑+H2O,配平该方程式,当有19.2克铜参加反应,转移电子多少mol?被还原的HNO3多少mol?生成的气体体积为多少升?(标况下)分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,Cu失去电子数=转移电子数,结合电子守恒可知被还原的硝酸及生成NO,以此来解答.
解答 解:Cu+HNO3=Cu(NO3)2+NO↑+H2O中Cu由0升高为+2价,N元素的化合价由+5价降低为+2价,由电子、原子守恒可知反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,转移电子为0.3mol×(2-0)=0.6mol,被还原的硝酸为$\frac{0.6mol}{(5-2)}$=0.2mol,结合N原子守恒可知生成NO气体的体积为0.2mol×22.4L/mol=4.48L,
答:反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,有19.2克铜参加反应,转移电子为0.6mol,被还原的HNO3为0.2mol,生成的气体体积为4.48L.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化、电子及原子守恒为解答本题关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
18.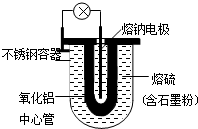 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的负极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |
16.下列实验操作能达到实验目的是( )
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
2.X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
9.硫酸具有重要的用途,某工厂用如图2示的工艺流程生产硫酸.
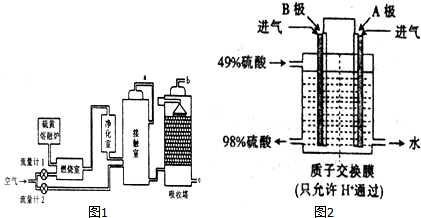
请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
该铵盐的成分是NH4HSO3和(NH4)2SO3,其物质的量之比是1:1.

请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
6.为配制c(NH4+):c(Cl-)=1:1的溶液,可在NH4Cl溶液中加入适量( )
| A. | 盐酸 | B. | 硫酸 | C. | 氨水 | D. | NaOH溶液 |
7.用分液漏斗可以分离的一组液体混合物是( )
| A. | I2和CCl4 | B. | 乙醇和水 | C. | 汽油和苯 | D. | 水和甲苯 |
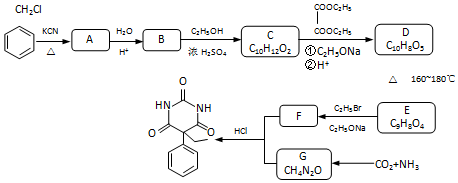
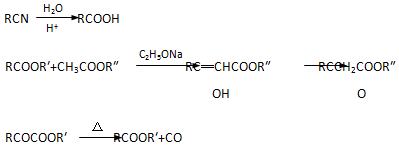
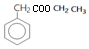 ;GCO(NH2)2.
;GCO(NH2)2.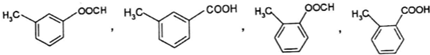 .
.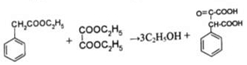 .
.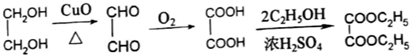 .
.