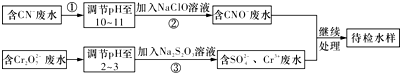
题目内容
2.X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
分析 X、Y、Z、R、W是5种短周期元素,原子序数依次增大.已知Y、R同主族,且形成共价化合物RY3,则R为S元素,Y为O元素;离子化合物Z2Y中Z的化合价为+1价,Y的化合价为-2价,分别为ⅠA族和ⅥA族元素,Z、R、W同周期,则Z为Na元素;W原子序数最大,则W是Cl元素,根据XW4可知X为C元素,以此解答.
解答 解:由以上分析可知X、Y、Z、R、W分别为C、O、Na、S、Cl,
A.同周期元素从左到右原子半径逐渐减小,Z、R、W同周期,分别为Na、S、Cl,原子序数逐渐增大,则原子半径逐渐减小,故A正确;
B.非金属性Cl>S,则氢化物稳定性HCl>H2S,故B正确;
C.XW4为CCl4,分子中C原子最外层为4+4=8个电子,Cl原子最外层为7+1=8个电子,故C正确;
D.Y、Z、R三种元素组成的化合物有Na2SO3、Na2SO4等,其溶液分别呈碱性和中性,故D错误.
故选D.
点评 本题考查位置结构性质的相互关系应用,为高频考点,侧重于学生的分析能力的考查,题目难度中等,同主族元素Y、R形成的化学式是推断突破口,再根据物质的化学式判断元素的化合价确定元素.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
3.下列说法正确的是( )
| A. | 用广泛pH试纸测得某溶液的pH为0 | |
| B. | 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 | |
| C. | 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小 |
1.在某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | NH4+、SO42-、Al3+、Cl- | B. | Na+、OH-、K+、Cl- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、NO3-、I-、Na+ |
8.铜与稀硝酸反应方程式为:Cu+HNO3=Cu(NO3)2+NO↑+H2O,配平该方程式,当有19.2克铜参加反应,转移电子多少mol?被还原的HNO3多少mol?生成的气体体积为多少升?(标况下)
14.铝土矿的主要成分为氧化铝,还有少量的氧化铁和二氧化硅杂质.工业上经过下列工艺可以冶炼金属铝:
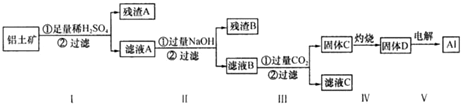
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
12.下列说法不正确的是( )
| A. | 碘易升华,应该密封保存 | |
| B. | 液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来 | |
| D. | 用加热的方法可以将NH4Cl与碘的混合物分离 |
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.