题目内容
6.为配制c(NH4+):c(Cl-)=1:1的溶液,可在NH4Cl溶液中加入适量( )| A. | 盐酸 | B. | 硫酸 | C. | 氨水 | D. | NaOH溶液 |
分析 氯化铵是强酸弱碱盐,由于NH4+水解,导致溶液中c(NH4+)<c(Cl-),氢离子浓度大于氢氧根离子浓度,溶液呈酸性;为了配制NH4+与Cl-的浓度比为1:1的溶液,须加一定量的能电离出铵根离子的物质,或减少溶液中氯离子的浓度,据此分析.
解答 解:氯化铵是强酸弱碱盐,由于NH4+水解,导致溶液中c(NH4+)<c(Cl-),溶液呈酸性,为了配制NH4+与Cl-的浓度比为1:1的溶液,须增加铵根离子浓度;或减少溶液中氯离子的浓度,
A.适量的盐酸,溶液中氯离子浓度增大,则溶液中c(NH4+)<c(Cl-),故A错误;
B.加硫酸,抑制铵根离子的水解,但是NH4+还有少量的水解,则溶液中c(NH4+)<c(Cl-),故B错误;
C.适量氨水,通过增加一水合氨浓度从而抑制铵根离子的水解,增加溶液中铵根离子的浓度,并保持氯离子浓度不变,故C正确;
D.适量NaOH,会发生反应:NH4++OH-=NH3•H2O,NH4+越来越少,氯离子浓度不变,导致c(NH4+)<c(Cl-),故D错误;
故选C.
点评 本题主要考查了NH4Cl溶液的配制,解答须掌握铵根离子水解的影响因素,掌握盐类水解的规律是解答本类题的关键,题目难度不大.

练习册系列答案
相关题目
7.下列有关硝酸的说法中,正确的是( )
| A. | 将可调高度的铜丝伸入稀硝酸中,溶液变蓝,说明Cu与稀硝酸发生置换反应 | |
| B. | 稀硝酸可除去试管内壁的银镜 | |
| C. | 常温下,将浓硝酸滴加到用砂纸打磨过上,会产生红棕色气体 | |
| D. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,则会有气体生成,溶液呈红色,说明稀硝酸将Fe氧化为Fe3+ |
8.铜与稀硝酸反应方程式为:Cu+HNO3=Cu(NO3)2+NO↑+H2O,配平该方程式,当有19.2克铜参加反应,转移电子多少mol?被还原的HNO3多少mol?生成的气体体积为多少升?(标况下)
14.铝土矿的主要成分为氧化铝,还有少量的氧化铁和二氧化硅杂质.工业上经过下列工艺可以冶炼金属铝:
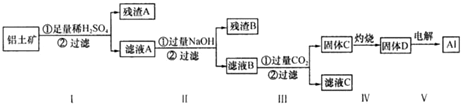
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
1.在标准状况下,将4.48LSO2、CO2、H2的混合气通入适量的饱和NaHCO3溶液中,充分反应后,若溶液中的溶质只有NaHSO3,并且逸出的4.6g气体中只有CO2和H2,则原有混合气体中SO2、CO2、H2的体积比可能是( )
| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:3 | D. | 2:2:3 |
18.下列反应的离子方程式正确的是( )
| A. | 明矾可以净水:Al3++3H2O=Al(OH)3(胶体)↓+3H+ | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O |
15.在某学生的化学实验报告中有如下记录其中实验数据合理的( )
| A. | 用托盘天平称取11.7 g CuO粉末 | |
| B. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| C. | 温度计上显示的室温读数为25.68℃ | |
| D. | 用广泛pH试纸测得溶液的pH为3.5 |

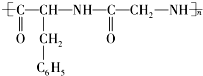 的单体是( )
的单体是( )