题目内容
16.下列实验操作能达到实验目的是( )| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
分析 A.Br2(g)和NO2(g)均可氧化KI;
B.乙醛和丙醛均含-CHO;
C.CH2=CH2被高锰酸钾氧化生成二氧化碳;
D.称量后,在烧杯中溶解可配制10%的NaCl溶液.
解答 解:A.Br2(g)和NO2(g)均可氧化KI,则均使湿润的KI-淀粉试纸变蓝,现象相同,不能鉴别,故A错误;
B.乙醛和丙醛均含-CHO,均与新制Cu(OH)2悬浊液反应生成砖红色沉淀,现象相同,不能鉴别,故B错误;
C.CH2=CH2被高锰酸钾氧化生成二氧化碳,再干燥不能得到纯净的甲烷,故C错误;
D.称量后,在烧杯中溶解可配制10%的NaCl溶液,需要的仪器为托盘天平、量筒、烧杯、玻璃捧,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、鉴别、溶液配制为解答本题关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
7.下列有关硝酸的说法中,正确的是( )
| A. | 将可调高度的铜丝伸入稀硝酸中,溶液变蓝,说明Cu与稀硝酸发生置换反应 | |
| B. | 稀硝酸可除去试管内壁的银镜 | |
| C. | 常温下,将浓硝酸滴加到用砂纸打磨过上,会产生红棕色气体 | |
| D. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,则会有气体生成,溶液呈红色,说明稀硝酸将Fe氧化为Fe3+ |
11.关于常温下pH均为12的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
1.在某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | NH4+、SO42-、Al3+、Cl- | B. | Na+、OH-、K+、Cl- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、NO3-、I-、Na+ |
8.铜与稀硝酸反应方程式为:Cu+HNO3=Cu(NO3)2+NO↑+H2O,配平该方程式,当有19.2克铜参加反应,转移电子多少mol?被还原的HNO3多少mol?生成的气体体积为多少升?(标况下)
14.铝土矿的主要成分为氧化铝,还有少量的氧化铁和二氧化硅杂质.工业上经过下列工艺可以冶炼金属铝:
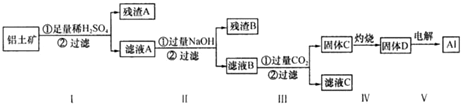
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
15.在某学生的化学实验报告中有如下记录其中实验数据合理的( )
| A. | 用托盘天平称取11.7 g CuO粉末 | |
| B. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| C. | 温度计上显示的室温读数为25.68℃ | |
| D. | 用广泛pH试纸测得溶液的pH为3.5 |
 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜. 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.