题目内容
14.已知A,B、C,D、E是短期中原子序数依次增大的5种主族元素,其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素,据此分析解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素,
A.由C、H元素组成的化合物,比如苯在常温下呈液态,故A错误;
B.元素C的最高价氧化物对应的水化物是氢氧化钠、D的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝与氢氧化钠反应生成偏铝酸钠,故B正确;
C.工业上制备氢气主要用C与水蒸气反应,以及电解饱和食盐水、电解水等方法,电解熔融氯化钠生成金属钠,电解熔融的氧化铝生成铝,故C错误;
D.化合物AE是HCl,属于共价化合物,含有共价键;化合物CE是NaCl,属于离子化合物,含有离子键,二者含有的化学键类型不同,故D错误;
故选B.
点评 本题考查元素的推断及其元素的性质.本题的突破口是掌握原子结构的有关知识,如原子最外层电子数是其电子层数的2倍,则为C元素;熟悉常见的物质,如元素的合金是日常生活中常用的金属材料等

| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A. | U形管内水的红水褪色 | B. | 试管内溶液变红 | ||
| C. | 气球a被吹大 | D. | U形管中水位不变 |
| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
 重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )
重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )| A. | 该有机物的分子式为C15H22O4 | |
| B. | 1mol该有机物与足量Na反应生成1molH2 | |
| C. | 该有机物能发生取代、加成和水解反应 | |
| D. | 1mol该有机物与足量溴反应最多消耗4molBr2 |
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
| A. | 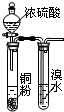 验证浓硫酸具有强氧化性 | B. |  制取干燥的NH3 | ||
| C. |  干燥、收集并吸收多余SO2 | D. | 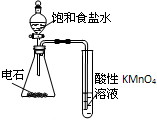 验证乙炔的还原性 |
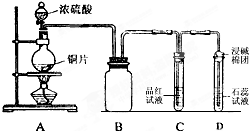 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.