题目内容
2.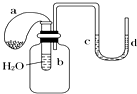 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A. | U形管内水的红水褪色 | B. | 试管内溶液变红 | ||
| C. | 气球a被吹大 | D. | U形管中水位不变 |
分析 Na2O2与水反应生成氢氧化钠和氧气,反应放热,可使广口瓶内压强增大,过氧化钠具有强氧化性,以此解答该题.
解答 解:由于发生反应2Na2O2+2H2O═4NaOH+O2↑,产生O2使气球膨胀,该反应放出大量热量,使锥形瓶中空气受热膨胀而出现U形管中水位d>c,由于浅红色的水是在U形管中而非试管中,则试管内溶液不变色,U形管内的红水不褪色,
故选:C.
点评 本题考查过氧化钠,侧重于学生的实验观察能力的培养和基础知识的考查,难度不大,此题解答时容易因定向思维而错选A、B,而没有注意到浅红色的水是在U形管中而非试管中.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
11.酚酞是中学阶段常用的酸碱指示剂,已知的结构简式如图所示,下列关于酚酞的说法正确的是( )
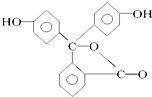

| A. | 酚酞属于芳香烃 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在碱性条件下能够发生水解反应 |
13.25℃时,下列叙述正确的是( )
| A. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| B. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | AgCl在水中溶解度与在稀盐酸中溶解度相同 | |
| D. | KNO3溶液和CH3COONH4溶液pH均为7,则两溶液中水的电离程度相同 |
10.利用下列实验装置能 完成相应实验的是( )
| A. | 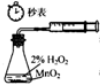 装置测定化学反应速率 | B. | 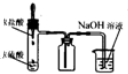 装置制取并吸收HCl | ||
| C. |  装置制备纯净NH3 | D. | 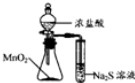 装置比较MnO2、Cl2、S |
17.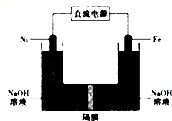 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
7.有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占的体积相同,则甲可能的结构有( )
| A. | 12种 | B. | 14种 | C. | 16种 | D. | 18种 |
14.已知A,B、C,D、E是短期中原子序数依次增大的5种主族元素,其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
11.铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解.若向反应后的溶液中加入下列物质,相关推断错误的是( )
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
12.下列关于化学与生产、生活的认识正确的是( )
| A. | 用米汤检验含碘盐中的碘酸钾 | |
| B. | 纤维素、蛋白质、塑料、天然橡胶都是高分子化合物 | |
| C. | 日常生活中常用无水乙醇进行杀菌消毒 | |
| D. | 光化学烟雾、臭氧层空洞、温室效应、硝酸型酸雨的形成都与氮氧化合物有关 |