题目内容
3.用下列实验装置室温下进行相应实验,能达到实验目的是( )| A. | 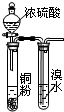 验证浓硫酸具有强氧化性 | B. | 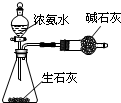 制取干燥的NH3 | ||
| C. | 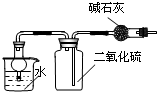 干燥、收集并吸收多余SO2 | D. | 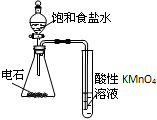 验证乙炔的还原性 |
分析 A.浓硫酸与铜粉常温下不反应;
B.氧化钙与水反应是放热反应;
C.二氧化硫是酸性气体;
D.生成的乙炔中含有H2S、PH3等还原性气体.
解答 解:A.浓硫酸与铜粉常温下不反应,加热才反应,故A错误;
B.氧化钙与水反应是放热反应,可用浓氨水和水制取氨气,故B正确;
C.二氧化硫是酸性气体,不能用碱石灰干燥,故C错误;
D.生成的乙炔中含有H2S、PH3等还原性气体,应将杂质除去方能证明乙炔的还原性,故D错误.
故选B.
点评 本题考查化学实验方案的评价,涉及物质的制备、分离和检验等实验操作,侧重于物质性质的考查,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
13.25℃时,下列叙述正确的是( )
| A. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| B. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | AgCl在水中溶解度与在稀盐酸中溶解度相同 | |
| D. | KNO3溶液和CH3COONH4溶液pH均为7,则两溶液中水的电离程度相同 |
14.已知A,B、C,D、E是短期中原子序数依次增大的5种主族元素,其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
11.铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解.若向反应后的溶液中加入下列物质,相关推断错误的是( )
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
18.下列有关化学用语表示正确的是( )
| A. | 二氧化碳分子的比例模型  | |
| B. | 芳香烃的组成通式 CnH2n-6(n≥6) | |
| C. | 12C、14C原子结构示意图均可表示为  | |
| D. | 羟基的电子式  |
15.单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )
| A. | 0.01 mol/L的蔗糖溶液 | B. | 0.02 mol/L的CH3COOH溶液 | ||
| C. | 0.02 mol/L的NaCl溶液 | D. | 0.01 mol/L的K2SO4溶液 |
12.下列关于化学与生产、生活的认识正确的是( )
| A. | 用米汤检验含碘盐中的碘酸钾 | |
| B. | 纤维素、蛋白质、塑料、天然橡胶都是高分子化合物 | |
| C. | 日常生活中常用无水乙醇进行杀菌消毒 | |
| D. | 光化学烟雾、臭氧层空洞、温室效应、硝酸型酸雨的形成都与氮氧化合物有关 |
13.从海带中提取碘,可经过如图实验步骤完成.下列有关说法正确的是( )

| A. | 灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒 | |
| B. | 氧化过程中发生反应的离子方程式为:2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体 |
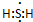 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.