题目内容
9.铜、锌、稀硫酸组成的原电池,当导线中通过2mole-时,下列说法正确的是( )| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
分析 锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,以此解答该题.
解答 解:锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,正极材料是铜,溶液中氢离子得到电子生成氢气,电极反应2H++2e-=H2↑,锌做负极失电子生成锌离子,电极反应为:Zn-2e-=Zn2+,当导线中有2mol电子通过时,
负极上Zn失电子而溶解,Zn片溶解的质量=65g/mol×$\frac{2mol}{2}$=65g,
正极上氢离子得电子发生还原反应,所以铜片上生成氢气的物质的量=$\frac{2mol}{2}$=1mol,生成的氢气的质量为1mol×2g/mol=2g,
A、锌片溶解了65克,铜片上放出了1mol氢气,故A正确;
B、锌片溶解了65克,铜片上放出2g氢气,两极上溶解和析出的物质质量不等,故B错误;
C、锌片溶解了65克,铜片上放出2g氢气,所以锌片每溶解32.5g,铜片上就析出氢气1g,故C错误;
D、根据总反应Zn+H2SO4=ZnSO4+H2↑,所以锌片溶解了1mol,硫酸就消耗1mol,故D正确;
故选AD.
点评 本题以原电池原理为载体考查了物质的量的有关计算,难度不大,根据电池反应式计算即可.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
18.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:催化条件下通入H2;②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;③除去C2H4中少量的SO2:气体通过盛氢氧化钠溶液的洗气瓶;④除去乙醇中少量的水:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:催化条件下通入H2;②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;③除去C2H4中少量的SO2:气体通过盛氢氧化钠溶液的洗气瓶;④除去乙醇中少量的水:加足量生石灰,蒸馏.
| A. | ①②④ | B. | ②④ | C. | ①③④ | D. | ③④ |
20.CO在空气中体积分数为0.13~0.74之间时,会发生猛烈的爆炸.当CO与空气中的O2恰好完全反应时,爆炸最猛烈.现有CO与空气的混合气体发生爆炸后,则生成的C02的体积分数可能为(设空气中N2的体积分数为0.79,O2为0.21)( )
| A. | 0.10 | B. | 0.20 | C. | 0.30 | D. | 0.40 |
17.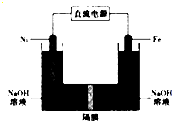 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
4.化学来源于生活,也服务于生活,下列有关生活中的化学叙述正确的是( )
| A. | 冰箱中使用的含氟制冷剂泄露后,会增加空气中的PM2.5 | |
| B. | 节日焰火的五彩缤纷是某些金属单质性质的体现 | |
| C. | 施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 | |
| D. | 化学反应能够制造出新的物质,同时也能制造出新的元素 |
14.已知A,B、C,D、E是短期中原子序数依次增大的5种主族元素,其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
18.下列有关化学用语表示正确的是( )
| A. | 二氧化碳分子的比例模型 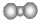 | |
| B. | 芳香烃的组成通式 CnH2n-6(n≥6) | |
| C. | 12C、14C原子结构示意图均可表示为 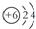 | |
| D. | 羟基的电子式 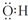 |
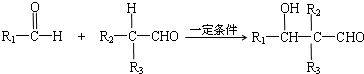
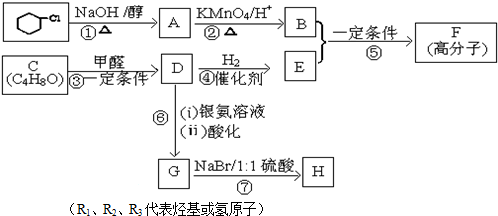
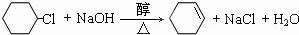 .
.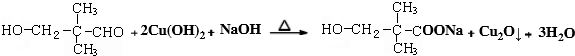
 .
.