题目内容
6.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
分析 A.以石墨为电极分别电解水阳极上氢氧根离子放电生成氧气和水,以石墨为电极分别电解饱和食盐水阳极氯离子放电生成氯气;
B.电解水溶液pH不变,电极饱和氯化钠溶液生成氢氧化钠和氯气和氢气,pH变大;
C.以石墨为电极分别电解水和饱和食盐水都是氢离子得到电子生成氢气;
D.依据电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑~2e-,结合转移电子数相等解答.
解答 解:A.以石墨为电极分别电解水阳极上4OH--4e-=2H2O+O2↑,以石墨为电极分别电解饱和食盐水阳极2Cl--2e-=Cl2↑,二者电极反应式不同,故A错误;
B.电解水溶液pH不变,电极饱和氯化钠溶液生成氢氧化钠和氯气和氢气,pH变大,所以电解结束后所得液体的pH不相同,故B错误;
C.以石墨为电极分别电解水和饱和食盐水都是:2H++2e-=H2↑,所以电极反应式相同,故C正确;
D.生转移电子数为4mol,则依据电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-,电解水生成3mol气体;
依据电解方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑~2e-,电解食盐水生成4mol气体,故D错误;
故选:C.
点评 本题考查了电解饱和食盐水和电解水,明确电解池工作原理、准确判断电极及发生反应是解题关键,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
16.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示,已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
17.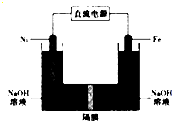 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
14.已知A,B、C,D、E是短期中原子序数依次增大的5种主族元素,其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
11.铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解.若向反应后的溶液中加入下列物质,相关推断错误的是( )
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
18.下列有关化学用语表示正确的是( )
| A. | 二氧化碳分子的比例模型 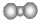 | |
| B. | 芳香烃的组成通式 CnH2n-6(n≥6) | |
| C. | 12C、14C原子结构示意图均可表示为 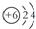 | |
| D. | 羟基的电子式 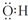 |
15.单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )
| A. | 0.01 mol/L的蔗糖溶液 | B. | 0.02 mol/L的CH3COOH溶液 | ||
| C. | 0.02 mol/L的NaCl溶液 | D. | 0.01 mol/L的K2SO4溶液 |
16.某小组以醋酸为例探究弱酸的性质.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
②实验步骤:a)检查装置(图1)的气密性后,添加药品;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
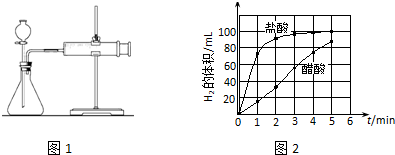
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol•L-1 NaOH标准溶液装入 碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
 .
.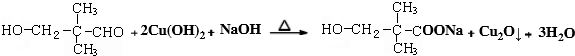
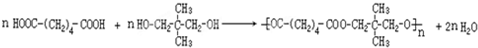 .
.