题目内容
【题目】下列各组中两种物质无论以何种比例混合,只要混合的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
A.C3H6、C3H8OB.C2H4、C2H6O
C.CH4O、C2H4O3D.C2H2、C6H6
【答案】C
【解析】
根据燃烧反应通式CxHyOz+(![]() )O2 → xCO2+
)O2 → xCO2+![]() H2O,有机物混合的总物质的量一定,完全燃烧时生成水的质量和消耗O2的质量均不变,说明两种有机物的氢原子数目一致,且
H2O,有机物混合的总物质的量一定,完全燃烧时生成水的质量和消耗O2的质量均不变,说明两种有机物的氢原子数目一致,且![]() 等式数值一致。
等式数值一致。
A.C3H6和C3H8O的氢原子数目不一致,A错误;
B.C2H4和C2H6O的氢原子数目不一致,B错误;
C.CH4O和C2H4O3的氢原子数目均为4,且![]() 均为1.5,C正确;
均为1.5,C正确;
D.C2H2和C6H6的氢原子数目不一致,D错误。
答案为C。

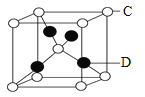
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制环己烯。
已知:![]()
密度( | 熔点℃ | 沸点℃ | 溶解性 | |
环己醇 | 0.096 | 25 | 161 | 能溶于水 |
环己烯 | 0.081 | -103 | 83 | 难溶于水 |
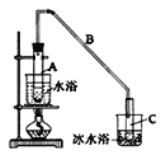
制备粗品:
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中瓷片的作用是______,导管B除了导气外还具有的作用是______;
(2)试管C置于冰水浴中的目的是__________________________。
制备精品:
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入少量食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用_________(填入编号)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
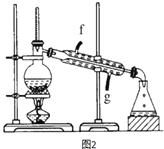
(4)再将环己烯按图2装置蒸馏,冷却水从_______(填f或g)口进入,蒸馏时要加入生石灰,目的是______________。收集产品时,温度应控制在_____左右。
(5)以下区分环己烯精品与粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
若用上述装置制备乙酸乙酯,回答下列问题。
(6)用分液漏斗提纯试管C中的乙酸乙酯,在操作时要注意振荡洗涤后,静置分液前必须放气,具体操作方法是__________(填编号)
a.将仪器正放在架子或铁圈上打开上部塞子
b.将仪器正放在架子或铁圈上打开活塞
c.用手心抵住仪器上部塞子倒置后打开活塞
d.将该仪器平放在实验台上打开活塞
(7)所制得的酯应从该分液漏斗的__________(填编号)
a.下部流出 b.上口倒出 c.都可以
(8)在提纯乙酸乙酯时,为什么要使用饱和碳酸钠溶液,而不用NaOH溶液洗涤?
______________________________________。