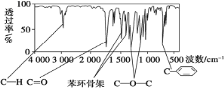
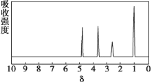
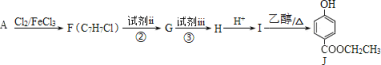
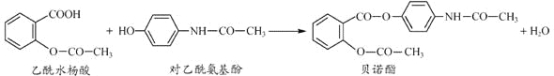
题目内容
【题目】室温下,甲、乙两烧杯均盛有5mLpH=3的醋酸溶液,向乙烧杯加水稀释至溶液pH=4,关于两烧杯中所得溶液的描述正确的是( )
A.溶液体积:10V甲<V乙
B.水电离出的OH-浓度:10c(OH-)甲 < c(OH-)乙
C.若分别用等物质的量浓度的NaOH溶液完全中和,所得溶液的pH:甲<乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲<乙
【答案】AD
【解析】
A.醋酸为弱酸,加水稀释时,促进醋酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,故A正确;
B.醋酸溶液中的氢氧根离子是水电离出来的,则pH=3的醋酸中,水电离的氢氧根离子浓度为c(OH)甲=![]() =1011mol/L,pH=4的醋酸中,水电离的氢氧根离子浓度为c(OH)乙=
=1011mol/L,pH=4的醋酸中,水电离的氢氧根离子浓度为c(OH)乙=![]() =1010mol/L,则10 c(OH)甲=c(OH)乙,故B错误;
=1010mol/L,则10 c(OH)甲=c(OH)乙,故B错误;
C.稀释前后甲乙两个烧杯中所含的醋酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,由于醋酸是弱酸,则甲溶液水解导致的pH大于乙,即:甲>乙,故C错误;
D.由于醋酸是弱酸,则反应后醋酸有剩余,甲中剩余酸浓度大,酸性强,pH小,所得溶液的pH:甲<乙,故D正确;
故答案选AD。

 小学课时特训系列答案
小学课时特训系列答案【题目】氧化铜与硫酸反应得硫酸铜。
(1)胆矾晶体结晶水含量测定实验中,恒重操作完成的标准是______________。
(2)利用如图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量如图下方的表格所示。

装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:_______________。