题目内容
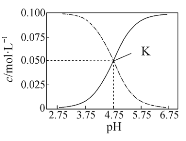
【题目】常温下,在HA和NaA的混合溶液中 c(HA)+c(A-)=0.1 mol·L-1,溶液中c(HA) 和c(A-)的大小随着pH变化的关系如图所示。下列有关叙述不正确的是
A.常温下,HA的电离平衡常数约为10-5
B.在pH=3.75溶液中:c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1
C.在pH=5.75溶液中:c(OH-)<c(H+)<c(A-)<c(HA)
D.在K点的溶液中,HA的电离程度大于A-的水解程度
【答案】C
【解析】
由图像知实线为c(A-)浓度大小,虚线为c(HA)浓度大小,
A. 根据图像K点知,此时c(A-)=c(HA)=0.050mol/L,c(H+)=10-4.75mol/L,则常温下,HA的电离平衡常数![]() ,即数量级为
,即数量级为![]() ,故A正确;
,故A正确;
B. 根据电荷守恒得:c(Na+)+c(H+) = c(OH-) +c(A-),已知c(HA)+c(A-)=0.1 mol·L-1,两式相加得c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1,故B正确;
C. 在pH=5.75溶液时,溶液呈酸性,c(OH-)<c(H+);由图像知,c(HA)<c(A-)中,故C错误;
D. 由选项A知HA的电离平衡常数Ka=c(H+)=10-4.75,则A-的水解平衡常数Kh=![]() <10-4.75,Kh<Ka,说明HA的电离程度大于A-的水解程度,故D正确;
<10-4.75,Kh<Ka,说明HA的电离程度大于A-的水解程度,故D正确;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却
【题目】测定硫酸铜晶体(CuSO4XH2O )中X值的实验过程如下:
![]()
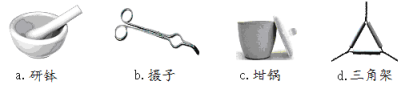
(1)下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
(2)“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;“冷却”放在_______________中(填仪器名称)。
(3) “恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(4)下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01),实验相对误差是_________________。(保留小数点后一位)
(5)这次实验中产生误差的原因可能是__________所造成的。
a.硫酸铜晶体中含有不挥发性杂质 b.在加热过程发现有黑色物质生成
c.加热时有晶体飞溅出来 d.加热失水后露置在空气中冷却