题目内容
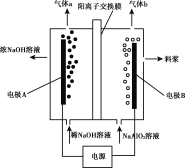
【题目】碲(Te)元素在元素周期表中位于第ⅥA族,其単质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)中提取单质碲,歩驟如下:
①将铜阳极泥在空气中焙烧使碲转化为TeO2;
②用NaOH溶液碱浸;
③以石墨为电极电解②所得溶液获得Te。
已知:TeO2微溶于水,易与较浓的强酸、强碱反应
下列说法不正确的是( )
A.Cu2Te中,Te的化合价是-2
B.歩骤②中,碱浸的子离方程式是:TeO2+2OH-=TeO32-+H2O
C.歩骤③中,阴极上发生反应的电极方程式是:TeO32-+4e-+6H+=Te+3H2O
D.在阳极区溶液中检验出有TeO42-存在,可能原因是阳极生成的氧气氧化TeO32-得到TeO42-
【答案】C
【解析】
工业上可从电解精炼铜的阳极泥(主要成分Cu2Te,还有少量的Ag、Au)中提取碲,铜阳极泥在空气中焙烧使碲转化为TeO2,其化学反应方程式为:Cu2Te+2O2![]() 2CuO+TeO2,用NaOH溶液碱浸,其化学反应方程式为:TeO2+2NaOH=Na2TeO3+H2O,以石墨为电极,电解Na2TeO3溶液时,溶液中的离子有Na+、H+、TeO32-、OH-,阴极得电子能力:TeO32- >H+>Na+,阴极的电极反应式为TeO32- +4e-+3H2O=Te↓+6OH-,阳极的电极反应式为4OH--4e-=2H2O+O2↑,亚碲酸根离子也可能发生氧化反应,其电极反应式为TeO32--2e-+2OH-= TeO42- +H2O。
2CuO+TeO2,用NaOH溶液碱浸,其化学反应方程式为:TeO2+2NaOH=Na2TeO3+H2O,以石墨为电极,电解Na2TeO3溶液时,溶液中的离子有Na+、H+、TeO32-、OH-,阴极得电子能力:TeO32- >H+>Na+,阴极的电极反应式为TeO32- +4e-+3H2O=Te↓+6OH-,阳极的电极反应式为4OH--4e-=2H2O+O2↑,亚碲酸根离子也可能发生氧化反应,其电极反应式为TeO32--2e-+2OH-= TeO42- +H2O。
A. S和Te为同主族元素,类比Cu2S,Cu2Te中,Te的化合价是-2,A正确;
B. TeO2与较浓的强酸、强碱反应,为两性氧化物,与碱强反应的化学反应方程式为:TeO2+2NaOH=Na2TeO3+H2O,其离子反应方程式为:TeO2+2OH-=TeO32-+H2O,B正确;
C.阴极上发生反应的电极方程式为: TeO32-+4e-+3H2O=Te↓+6OH-,C错误;
D. 阳极的电极反应式为4OH--4e-=2H2O+O2↑,亚碲酸根离子也可能发生氧化反应,其电极反应式为TeO32--2e-+2OH-= TeO42-+H2O,D正确;故答案为:C。

【题目】300℃时,将气体X和气体Y各1.6 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=________________
(2)温度为300℃时,该反应的化学平衡常数K=____________________
(3)右图表示该反应变化过程中物质的浓度与反应的时间变化关系。图中t2→t3间的曲线变化是由于下列哪种条件的改变所引起的_______
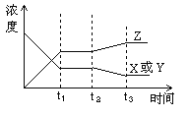
A.增大了压强 B.降低温度
C.增加了x和y的浓度 D.使用了催化剂
(4)若起始时向该容器中充入X、Y、Z各2.0 mol,则反应将向_______(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数=____________,平衡时n(Y)=_______________。