题目内容
【题目】常温下,向H2O2溶液中滴加少量Fe2(SO4)3溶液,反应原理如图所示。关于该反应过程的说法正确的是( )

A.该反应过程中,M是Fe3+,M′是Fe2+
B.当有1molO2生成时,转移2mo1电子
C.在H2O2分解过程中,溶液的pH逐渐降低
D.H2O2的氧化性比Fe3+强,还原性比Fe2+弱
【答案】B
【解析】
由反应原理图可知,2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+,总反应为2H2O2=2H2O+O2↑。
A. 由反应2Fe2++H2O2+2H+=2Fe3++2H2O可知,M是Fe2+,M′是Fe3+,A错误;
B. 由反应2Fe3++H2O2=2Fe2++O2↑+2H+可知,当生成1mol氧气,转移2mol电子,B正确;
C. 总反应为2H2O2=2H2O+O2↑,H+的量不变,反应生成的水对溶液有稀释作用,所以溶液的pH逐渐增大,C错误;
D. 反应2Fe2++H2O2+2H+=2Fe3++2H2O中,Fe2+被H2O2氧化生成Fe3+,则H2O2的氧化性比Fe3+强,反应2Fe3++H2O2=2Fe2++O2↑+2H+中,Fe3+被H2O2还原生成Fe2+,则H2O2的还原性比Fe2+强,D错误;故答案为:B。

【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。
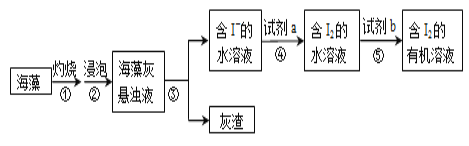
(1)③的操作名称是_______,所需的玻璃仪器有:_______⑤的操作名称是_______。
(2)试剂b可以是四氯化碳,还可以是_______(填名称)。选择四氯化碳的理由是:_____
(3)关于⑤的操作步骤,下列说法正确的是__________(填字母)。
A 振荡液体时,需要倒转分液漏斗
B 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D 分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:
_____I― +______H2O2+_________=_______I2+_________。(系数为“1”时,要写“1”)
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
物质 | 熔点 | 沸点 |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
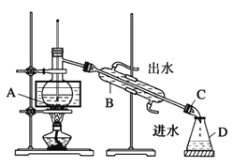
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,②图中有一个明显错误,应改正为_____________。