题目内容
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
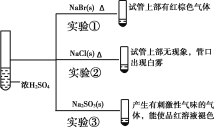
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
【答案】A
【解析】
A. 实验①生成棕色气体是溴蒸气,实验②白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气,与同一种氧化剂在相同条件下反应,溴离子被氧化成溴单质,而氯离子不能被氧化,说明还原性:Br>Cl,A正确;
B. 实验③生成是二氧化硫气体,非氧化还原反应,而且亚硫酸钠与溴化钠不是同一类型,所以不能比较Br2、SO2的氧化性,B错误;
C. 实验②白雾说明氯化氢易挥发,不能说明酸性H2SO4>HCl,而实验③生成是二氧化硫气体,非氧化还原反应,而是强酸制弱酸,能说明H2SO4>H2SO3,C错误;
D. 实验中不能得知浓硫酸具有脱水性,D错误;故答案为:A。

【题目】由下述实验现象,下列氯水对应结论不正确的是
实验 | 装置 | 试剂 A | 现象 |
① |
| 紫色石蕊溶液 | 先变红后褪色 |
② | 滴有 KSCN 的 FeCl2 溶液 | 溶液变红 | |
③ | NaHCO3 溶液 | 产生使澄清石灰水变浑浊的气体 | |
④ | HNO3 酸化的 AgNO3 溶液 | 产生白色沉淀 |
A.①氯水具有酸性和漂白性
B.②氯水具有还原性
C.③氯水中含有 H+
D.④氯水中含有 Cl-
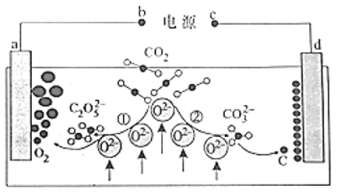
【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。
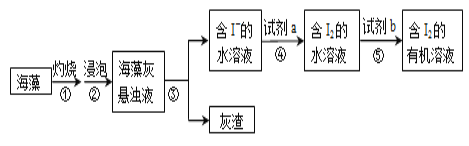
(1)③的操作名称是_______,所需的玻璃仪器有:_______⑤的操作名称是_______。
(2)试剂b可以是四氯化碳,还可以是_______(填名称)。选择四氯化碳的理由是:_____
(3)关于⑤的操作步骤,下列说法正确的是__________(填字母)。
A 振荡液体时,需要倒转分液漏斗
B 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D 分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:
_____I― +______H2O2+_________=_______I2+_________。(系数为“1”时,要写“1”)
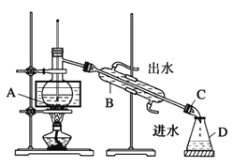
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
物质 | 熔点 | 沸点 |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,②图中有一个明显错误,应改正为_____________。
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
材料一、(见图)
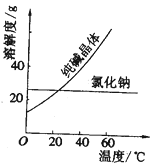
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。