题目内容
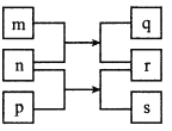
【题目】乳酸亚铁晶体〔CH3CH(OH)COO〕2Fe·2H2O是一种很好的食品铁强化剂,可由乳酸钙与FeCl2反应制得,制备流程如下:
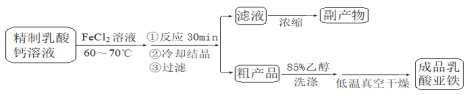
反应装置如下图所示:
已知:①潮湿的乳酸亚铁易被氧化
②物质的溶解性:
乳酸钙:溶于冷水,易溶于热水;乳酸亚铁:溶于冷水和热水,难溶于乙醇。
请回答:
(1)装置甲的气密性检查操作为_________
(2)部分实验操作过程如下,请按正确操作顺序填入字母,其正确的操作顺序是:检查气密性![]() 按图示要求加入试剂
按图示要求加入试剂![]() 将三颈烧瓶置于水浴中
将三颈烧瓶置于水浴中![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() 开动搅拌器
开动搅拌器![]() ……
……
a.关闭K1;
b.盖上分液漏斗上口玻璃塞;
c.关闭K3,打开K2;
d.关闭K2,打开K3;
e.打开分液漏斗上口玻璃塞;
f打开K1
(3)该装置制备乳酸亚铁的优点是_________副产物为_________
(4)下列说法正确的是_________
A.装置甲中的主要仪器是球形分液漏斗和蒸馏烧瓶
B.本实验采用较大铁片而不是铁粉的主要原因是控制反应速率,防止进入三颈烧瓶的氯化亚铁过多,反应过于剧烈
C.乳酸亚铁悬浊液应从b口倒出进行抽滤,并用滤液洗涤三颈烧瓶,将洗涤液倒入布氏漏斗再次抽滤
D.粗产品的洗涤液,经蒸馏后所得的残留液,与滤液混合可提高副产物的产量
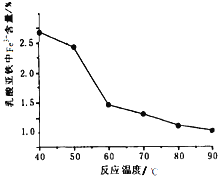
(5)在实验过程中FeCl2溶液和乳酸钙溶液混合即出现浑浊,继续在60℃-70℃下反应30分钟,静置冷却、抽滤、洗涤、低温真空干燥,得到成品,经测定得到反应温度和成品中Fe3+含量关系如图,60℃之后Fe3+含量明显较低的可能的原因是_________
(6)有同学提出可直接用KMnO4滴定法测定样品中的Fe2+量进而计算纯度,但实验后发现结果总是大于100%,其主要原因可能是_________
【答案】关闭K3、K2,打开分液漏斗活塞,打开K1,加入蒸馏水,若蒸馏水不能顺利流下,则证明甲装置气密性良好 d e f c a b 亚铁离子新制且反应装置处于氢气气氛中,产品不易被氧化,纯度高 氯化钙 AD 在较高温度下反应一段时间,有利于得到大颗粒沉淀,吸附的Fe3+的量少 KMnO4溶液可以氧化乳酸根,标准液消耗量变多,所以结果总是大于100%
【解析】
本实验由乳酸钙与FeCl2反应制得乳酸亚铁晶体,甲装置用于制取FeCl2溶液,因为亚铁离子易被空气中的氧气氧化,首先利用氢气排出装置内的空气,再利用产生的氢气使装置内压强增大,将FeCl2溶液压入三颈烧瓶中,使FeCl2溶液与乳酸钙反应生成乳酸亚铁晶体,经过滤得到乳酸亚铁晶体粗产品和CaCl2溶液,乳酸亚铁晶体粗产品用乙醇洗涤、低温真空干燥得到成品乳酸亚铁,CaCl2溶液进过浓缩得到副产物CaCl2,据此分析解答。
(1)首先关闭K3、K2,形成封闭体系,打开分液漏斗活塞,打开K1,加入蒸馏水,若蒸馏水不能顺利流下,则证明甲装置气密性良好,故答案为:关闭K3、K2,打开分液漏斗活塞,打开K1,加入蒸馏水,若蒸馏水不能顺利流下,则证明甲装置气密性良好;
(2)亚铁离子易被空气中的氧气氧化,需先用氢气排出装置内的空气,因此需要先关闭K2,打开K3,打开分液漏斗上口玻璃塞,打开K1,盐酸与铁反应生成氢气,排出空气,然后关闭K3,打开K2,产生的氢气使装置内压强增大,将氯化亚铁溶液压入三颈烧瓶中,然后关闭K1,盖上分液漏斗上口玻璃塞,开动搅拌器,使氯化亚铁溶液与乳酸钙反应生成乳酸亚铁,故答案为:d;e;f;c;a;b;
(3)该装置制备乳酸亚铁的优点是亚铁离子新制且反应装置处于氢气气氛中,产品不易被氧化,纯度高,副产物为氯化钙;
(4)A. 根据装置的构造可知,装置甲中的主要仪器是球形分液漏斗和蒸馏烧瓶,故A正确;
B. 本实验采用较大铁片而不是铁粉的主要原因是防止铁粉堵塞导管,故B错误;
C.乳酸亚铁悬浊液应从b口倒出进行抽滤,应用滤液洗涤三颈烧瓶,将洗涤液倒入布氏漏斗一起抽滤,故C错误;
D.粗产品的洗涤液,经蒸馏后所得的残留液,与滤液混合可提高副产物的产量,故D正确;故答案为:AD;
(5)60℃之后Fe3+含量明显较低的可能的原因是在较高温度下反应一段时间,有利于得到大颗粒沉淀,吸附的Fe3+的量少;
(6)乳酸根中的羟基可以被KMnO4氧化,也会消耗KMnO4,标准液消耗量变多,所以结果总是大于100%,故答案为:KMnO4溶液可以氧化乳酸根,标准液消耗量变多,所以结果总是大于100%。

【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
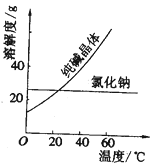
材料一、(见图)
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
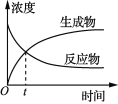
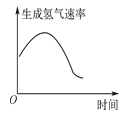
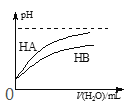
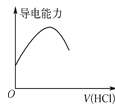
【题目】下列关于各图的叙述正确的是
|
|
|
|
甲 | 乙 | 丙 | 丁 |
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响
C. 图丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
D. 丁表示向氨水中通入HCl气体,溶液的导电能力变化
【题目】300℃时,将气体X和气体Y各1.6 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=________________
(2)温度为300℃时,该反应的化学平衡常数K=____________________
(3)右图表示该反应变化过程中物质的浓度与反应的时间变化关系。图中t2→t3间的曲线变化是由于下列哪种条件的改变所引起的_______
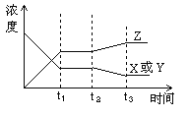
A.增大了压强 B.降低温度
C.增加了x和y的浓度 D.使用了催化剂
(4)若起始时向该容器中充入X、Y、Z各2.0 mol,则反应将向_______(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数=____________,平衡时n(Y)=_______________。