题目内容
11.(1)请完成该反应的离子方程式:5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
分析 (1)从反应物生成物所含元素的化合价变化可知该反应为氧化还原反应,经分析得知反应中C失去4个电子,由0→+4价,Mn得到5个电子,由+7→+2,依据氧化还原反应中得失电子守恒及原子个数守恒写成反应方程式;
(2)①计算化学反应达到化学平衡时物质的浓度,某种反应物的反应速率的计算公式为v=$\frac{△c}{△t}$;
②首先观察化学反应方程式,反应物和生成物系数相同,且反应物之间配比相同,所以该反应为等效平衡,计算两种条件下CO的转化率,在与温度比较后进行判断,可以得知该反应为放热反应;转化率=转化量/初始量,通过表格中给出的相关数据可以算出;
(3)①由图可知状态Ⅱ的压强大于状态Ⅰ压强的2倍,所以平衡逆向移动;
②根据表中数据分析可知1×106 Pa时物质B不在是气体,根据平衡常数的含义和方程式书写;
(4)依据水的离子积常数、溶度积常数表达式计算解答.
解答 解:(1)从反应物生成物所含元素的化合价变化可知该反应为氧化还原反应,经分析得知反应中C失去4个电子,由0→+4价,Mn得到5个电子,由+7→+2,依据氧化还原反应中得失电子守恒及原子个数守恒,该反应的化学方程式为:5C+4MnO4-+12H+═5CO2↑+4Mn2++6H2O;
故答案为:5,4,12,5,4,6;
(2)①已知平衡时c(H2)=1.6mol,所以c(CO2)=1.6mol,v(CO2)=$\frac{\frac{1.6mol}{2L}}{6min}$=0.13mol/(L•min),
故答案为:0.13mol/(L•min);
②实验1中CO的转化率为$\frac{1.6mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{0.4mol}{4mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;
故答案为:放; 20%;
(3)①由表格数据可知当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为$\frac{1}{2.5}$倍,浓度由0.08增大为0.20mol•L-1,也增大2.5倍,所以增大压强平衡不移动,
故答案为:不;
②由表格数据可知当压强从5×105Pa增大为1×106Pa时,压强增大2倍,体积变为$\frac{1}{2}$倍,浓度应该由0.20增大为0.40mol•L-1,但是实际上A的浓度为0.44,说明平衡逆移,则反应前气体的物质的量小于反应后气体的物质的量,则反应物B不在是气态,所以此反应的平衡常数表达式为K=$\frac{[C]^{p}}{[A]^{m}}$,
故答案为:$\frac{[C]^{p}}{[A]^{m}}$;
(4)pH为 5时溶液中C(OH-)=10-9mol/L,Ksp[Fe(OH)3]=[Fe3+][OH-],Fe3+=$\frac{Ksp}{[O{H}^{-}]^{3}}$=$\frac{4×1{0}^{-38}}{1×1{0}^{-27}}$=4×10-11;
故答案为:4×10-11.
点评 本题考查了氧化还原方程式的配平、化学反应速率、化学平衡移动的影响素、平衡常数表达式的书写、溶度积规则,题目综合性强,难度较大,注意对相关知识的积累.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
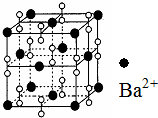 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
| A. | 通过足量的NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的酸性KMnO4溶液 |
| A. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)═c(H+)+c(HS-)+c (H2S) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合:c(HCN)+c(CN-)═2 c(Na+) |
| A. | 13 | B. | 14 | C. | 15 | D. | 12 |
