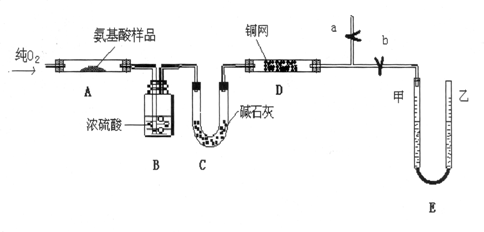
题目内容
6.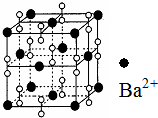 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为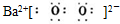 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
分析 A.由阴阳离子构成的晶体为离子晶体,离子晶体中可能含有共价键;
B.该晶胞中Ba离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧根离子个数=1+12×$\frac{1}{4}$=4,则钡离子和过氧根离子个数之比为4:4=1:1,据此确定化学式;
C.由B选项知晶体的化学式为Ba2O2,由图知两个氧原子以过氧根离子存在;
D.与每个Ba2+距离相等且最近的Ba2+个数=3×8×$\frac{1}{2}$.
解答 解:A.该晶胞是由金属阳离子钡离子和阴离子过氧根离子构成的,为离子晶体,故A错误;
B.该晶胞中Ba离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧根离子个数=1+12×$\frac{1}{4}$=4,则钡离子和过氧根离子个数之比为4:4=1:1,其化学式为BaO2,故B错误;
C.由B选项知晶体的化学式为Ba2O2,由图知两个氧原子以过氧根离子存在,故该氧化物的电子式为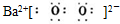 ,故C正确;
,故C正确;
D.与每个Ba2+距离相等且最近的Ba2+个数=3×8×$\frac{1}{2}$=12,故D错误;
故选:C.
点评 本题考查晶胞计算,侧重考查分析、计算、空间想象能力,以教材中氯化钠、氯化铯为例采用知识迁移方法解答离子晶体晶胞有关计算,难点是配位数的计算方法.

练习册系列答案
相关题目
1.甲基多巴是一种降压药,其结构如图所示,下列有关说法正确的是( )


| A. | 分子式为C10H14NO4 | |
| B. | 分子中有一个手性碳原子 | |
| C. | 甲基多巴具有两性,且能发生酯化反应 | |
| D. | 1mol甲基多巴分子最多能与2 mol NaOH反应 |
19.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.21的己烷所含的分子数为0.5 NA | |
| B. | 28g乙烯所含共用电子对数目为4 NA | |
| C. | 1mol苯乙烯中含有的C=C数为4NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
11.(1)请完成该反应的离子方程式:
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为0.13mol/(L•min).(精确到0.01)
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
①当压强从2×105 Pa增加到5×105Pa时,平衡不移动(填:向左,向右,不)
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
18.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83g X的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀.由此可推断出X的化学式为( )
| A. | K2SO4•2Cr2(SO4)3 | B. | 2K2SO4•Cr2(SO4)3 | C. | K2SO4•Cr2(SO4)3 | D. | K2SO4•$\frac{1}{2}$Cr2(SO4)3 |
15.下列变化过程中,化学键没有被破坏的是( )
| A. | HCl溶于水 | B. | 干冰升华 | ||
| C. | 固体NaCl熔融 | D. | 煤矿中瓦斯(主要成分CH4)遇火爆炸 |
16.可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6 区分开的试剂是( )
| A. | FeCl3溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | NaOH溶液 |

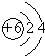 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0;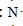 →
→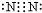 .
.