题目内容
19.A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).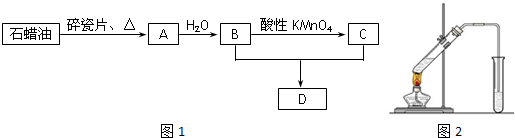
(1)工业上,由石油获得石蜡油的方法是减压分馏,由石蜡油获得A在石油化工中称为裂解.
(2)写出A→B的反应方程式:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3-CH2OH该反应的类型是加成反应写出反应B+C→D的化学方程式:CH2COOH+CH3CH2OH$\stackrel{一定条件下}{→}$CH3COOCH2CH3+H2O该反应的类型是取代反应(或酯化反应).
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是5mol
(4)实验室制备D的实验装置图如图所示:收集产物的试管中盛放的液体为饱和碳酸钠溶液;该溶液的作用有:①除掉产物中的乙酸和乙醇杂质;②降低乙酸乙酯在水中的溶解度,便于溶液分层
(5)在制备乙酸乙酯过程中,往往加入的乙酸和乙醇的量要比理论计算量多得多,请解析其中可能存在的原因:①原料来不及反应就被蒸出 ②温度过高发生了副反应.
分析 A产量可以衡量一个国家石油化工水平的高低,则A应为CH2=CH2,石蜡油发生裂化得到乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成C为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成D为乙酸乙酯,
(1)工业上,由石油分馏获得石蜡油,由石蜡油通过减压分馏获得乙烯,也称为裂化;
(2)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应B+C→D是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯;
(3)使乙烯与氯气发生完全加成反应生成1,2-二氯乙烷,然后与氯气在光照的条件下发生完全取代反应;
(4)实验室制备乙酸乙酯,用饱和碳酸钠溶液除去产物中的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于溶液分层;
(5)反应为可逆反应,乙酸和乙醇容易挥发,温度过高乙醇发生反应生成乙醚或者乙烯.
解答 解:A产量可以衡量一个国家石油化工水平的高低,则A应为CH2=CH2,石蜡油发生裂化得到乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成C为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成D为乙酸乙酯,
(1)工业上,由石油分馏获得石蜡油,由石蜡油获得乙烯属于裂化,是化学变化,
故答案为:减压分馏;裂解;
(2)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$ CH3-CH2OH,
反应B+C→D是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式是:CH2COOH+CH3CH2OH $\stackrel{一定条件下}{→}$ CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$ CH3-CH2OH;加成反应;CH2COOH+CH3CH2OH $\stackrel{一定条件下}{→}$ CH3COOCH2CH3+H2O;取代反应(或酯化反应);
(3)使1mol乙烯与氯气发生完全加成反应,消耗1mol氯气,反应生成1,2-二氯乙烷,然后与氯气在光照的条件下发生完全取代反应,消耗4mol氯气,则两个过程中消耗氯气的总物质的量是5mol,
故答案为:5;
(4)实验室制备乙酸乙酯,收集产物的试管中盛放的液体为:饱和碳酸钠溶液,该溶液可以除去产物中的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于溶液分层,
故答案为:饱和碳酸钠溶液;乙酸;乙醇;降低乙酸乙酯在水中的溶解度,便于溶液分层;
(5)由于酯化反应是可逆的过程,反应物不可能完全反应;原料来不及反应就被蒸出、温度过高发生了副反应等,都使加入的乙酸和乙醇的量要比理论计算量多得多,
故答案为:原料来不及反应就被蒸出;温度过高发生了副反应.
点评 本题考查了石蜡油分解制取乙烯及乙烯的化学性质、乙酸乙酯的制取等知识,题目难度中等,注意掌握乙烯的工业制法及化学性质,明确乙酸乙酯的制取原理.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| C. | 100 mL 0.2 mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
①粗盐和酸雨都是混合物
②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋均既是化合物又是酸
⑥纯碱和熟石灰都是碱
⑦雾、烟都是胶体
⑧利用丁达尔效应可以区分溶液和胶体.
| A. | ①②③④⑥ | B. | ①③④⑦⑧ | C. | ③④⑤⑥⑦ | D. | ①②④⑤⑧ |

吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇.回答下列问题:
(1)写出吸收池中反应的离子方程式CO2+CO32-+H2O=2HCO3-.
(2)从分解池中循环使用的物质是K2CO3.
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如表:
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
| A. | 甲烷 | B. | 正丁烷 | C. | 异丁烷 | D. | 丙烷 |
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
| A. | 将SO2通入溴水,溴水褪色 | |
| B. | 将SO2气体通入滴入有酚酞的NaOH溶液中,红色褪色 | |
| C. | 将SO2通入品红溶液中,品红溶液褪色 | |
| D. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色 |