题目内容
4.由碳的氧化物直接合成乙醇燃料已进入大规模生产.如图是由二氧化碳合成乙醇的技术流程: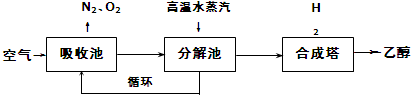
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇.回答下列问题:
(1)写出吸收池中反应的离子方程式CO2+CO32-+H2O=2HCO3-.
(2)从分解池中循环使用的物质是K2CO3.
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如表:
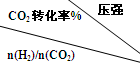 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
分析 (1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3;
(2)由工艺流程转化关系可知,分解池中KHO3分解生成K2CO3,碳酸钾在被循环利用;
(3)由表中数据可知,温度一定时,n(H2)/n(CO2)越大,CO2转化率越高,有利于CH3CH2OH生成.
解答 解:(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3,反应离子方程式为CO2+CO32-+H2O=2HCO3-,
故答案为:CO2+CO32-+H2O=2HCO3-;
(2)由工艺流程转化关系可知,分解池中KHO3分解生成K2CO3,碳酸钾在被循环利用吸收空气中二氧化碳,
故答案为:K2CO3;
(3)由表中数据可知,温度一定时,n(H2)/n(CO2)越大,CO2转化率越高,有利于CH3CH2OH生成,
故答案为:有利.
点评 本题考查了乙醇工业制法,题目难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.

练习册系列答案
相关题目
12.Ⅰ煤化工中常需研究不同温度下平衡常数、投料比等问题.
已知:CO (g)+H2O (g)?H2 (g)+CO2 (g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}0)}$,△H=<0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)?2CO (g)平衡常数K1
C(s)+H2O (g)?H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为80%;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正=v逆 (填“>”、“=”或“<”).
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
Ⅱ(4)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(5)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
表中x=2 ml,理由是保证其它条件不变,只改变H2C2O4的浓度,从而达到对比的目的.
已知:CO (g)+H2O (g)?H2 (g)+CO2 (g)平衡常数K随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)该反应的平衡常数表达式K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}0)}$,△H=<0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)?2CO (g)平衡常数K1
C(s)+H2O (g)?H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为80%;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正=v逆 (填“>”、“=”或“<”).
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
Ⅱ(4)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(5)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
9.下列物质对应关系正确的是( )
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
16.下列化学方程式书写正确的是( )
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HNO3(浓)═3Cu(N03)2+2N0↑+4H20 | ||
| C. |  +HO-NO2$\stackrel{浓硫酸}{→}$ +HO-NO2$\stackrel{浓硫酸}{→}$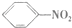 +H2O +H2O | D. | 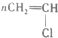 $\stackrel{引发剂}{→}$ $\stackrel{引发剂}{→}$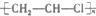 |
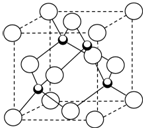 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.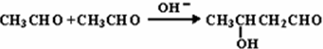
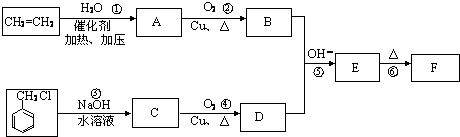
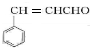 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.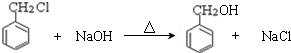
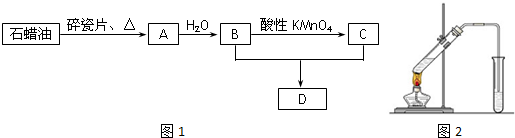
 ,它在常温下呈液态,形成晶体时,属于
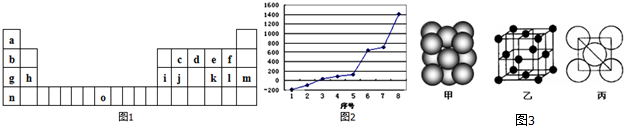
,它在常温下呈液态,形成晶体时,属于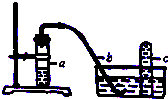 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.