题目内容
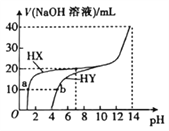
【题目】常温下,向![]() b
b ![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]() 的NaOH溶液,充分反应后溶液中c
的NaOH溶液,充分反应后溶液中c![]() c
c![]() ,下列说法不正确的是
,下列说法不正确的是
A.b![]()
B.混合后溶液呈中性
C.向![]() 溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
D.![]() 的电离常数
的电离常数 ![]()
【答案】C
【解析】
常温下,向10mLb![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]()
![]() 的NaOH溶液,充分反应后溶液中
的NaOH溶液,充分反应后溶液中![]() ,依据溶液中电荷守恒c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),则c(H+)=c(OH-),溶液呈中性,若恰好完全反应,生成醋酸钠溶液呈碱性,分析可知醋酸略微过量,
,依据溶液中电荷守恒c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),则c(H+)=c(OH-),溶液呈中性,若恰好完全反应,生成醋酸钠溶液呈碱性,分析可知醋酸略微过量,
A.根据分析,恰好反应生成醋酸钠溶液呈碱性,若溶液呈中性,醋酸过量,![]() ,故A正确;
,故A正确;
B.充分反应后溶液中![]() ,依据溶液中电荷守恒
,依据溶液中电荷守恒![]() ,分析可知
,分析可知![]() ,溶液呈中性,故B正确;
,溶液呈中性,故B正确;
C.![]() 溶液中,水的电离被抑制,随NaOH溶液滴加反应进行,水的抑制程度减弱,水电离程度增大,至溶液为中性,水的电离程度最大,故C错误;
溶液中,水的电离被抑制,随NaOH溶液滴加反应进行,水的抑制程度减弱,水电离程度增大,至溶液为中性,水的电离程度最大,故C错误;
D.根据分析,溶液呈中性, ![]() ,溶液等体积混合,离子浓度减小为原来的一半,
,溶液等体积混合,离子浓度减小为原来的一半,![]() =0.005mol/L,电离平衡常数
=0.005mol/L,电离平衡常数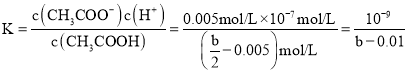 ,故D正确。
,故D正确。
答案选 C。

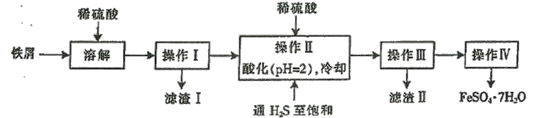
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。