题目内容
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
【答案】除去废铁屑表面的油污 降低FeSO4在水中的溶解度,减少FeSO4·7H2O的损耗 用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口 c 酸式滴定管 滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色 16.8%
【解析】
(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解;
(2)由于硫酸亚铁的溶解度随温度的升高而增大;
(3)①转移液体需要引流;②硝酸有强氧化性,盐酸有还原性;高锰酸钾有强氧化性,应放在酸式滴定管中;滴定终点时,颜色变成紫红色,并且半分钟内不褪色;配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,以此计算;
(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,所以可用纯碱溶液除油污,故答案为:除去废铁屑表面的油污;
(2)由于硫酸亚铁的溶解度随温度的升高二增大,因此用冰水洗涤的另一个目的是减少洗涤过程中FeSO47H2O的损耗,故答案为:降低FeSO4在水中的溶解度,减少FeSO47H2O的损耗;
(3)①转移液体需要引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口,故答案为:用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口;
②硝酸有强氧化性,盐酸有还原性,能被高能酸钾氧化为氯气,只能用稀硫酸;高锰酸钾有强氧化性,能氧化橡皮管,应放在酸式滴定管中;滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点;故答案为:c;酸式;滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色;
③配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,反应需要的高锰酸钾的物质的量为![]() ×10-3L×1.2×10-2mol/L=18×10-5mol
×10-3L×1.2×10-2mol/L=18×10-5mol
则:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 18×10-5mol
n=18×10-5mol×5=90×10-5mol,则1.500g硫酸亚铁补血剂药片含铁的质量为90×10-5mol×5×56g/mol =0.252g,所以该补血剂中铁元素的含量为![]() ×100%=16.8%;
×100%=16.8%;
故答案为:16.8%。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
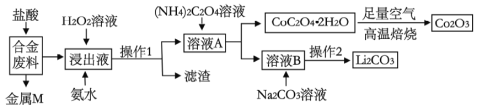
(1)合金废料中加入盐酸浸取,此处盐酸不能换为硝酸,原因是_______________。
(2)操作1用到的玻璃仪器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,应先加入_____________,加入氨水发生反应的离子方程式为____________________。
(4)在空气中焙烧CoC2O4·2H2O的化学方程式是____________________。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
则操作2的具体流程是_______________、_____________、洗涤、干燥。