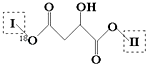
题目内容
【题目】25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
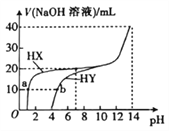
A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX+OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
【答案】B
【解析】A. 根据图像,0.1mol·L-1的HY的pH=4,即c(H+)=10-4 mol/L,则Ka(HY)= 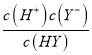 =
=![]() = 10-7,故A错误;B. 根据图像,0.1mol·L-1的HX的pH=1,0.1mol·L-1的HY的pH=4,说明HX为强酸,HY为弱酸,因此a点时溶质为NaX和HX,n(X-)=0.1mol/L×0.02L =0.002mol,;b点时溶质为NaY和HY,HY部分电离,n(Y-)<0.002mol,溶液体积相同,则c(X-)> c(Y-),故B正确;C. HX为强酸,发生反应的离子方程式为H++OH-=H2O,故C错误;D. pH=7时,HX为强酸,n(X-)=0.1mol/L×0.02L=0.002mol,c(X-)=0.05 mol/L;HY为弱酸,pH=7时c(H+)=c(OH-),溶质为NaY和HY,根据电荷守恒,有c(Y-)= c(Na+),由于氢氧化钠溶液的体积小于HY溶液的体积,则c(Y-)=c(Na+)<0.05 mol/L,因此c(Y-)<c(X-),故D错误;故选B。
= 10-7,故A错误;B. 根据图像,0.1mol·L-1的HX的pH=1,0.1mol·L-1的HY的pH=4,说明HX为强酸,HY为弱酸,因此a点时溶质为NaX和HX,n(X-)=0.1mol/L×0.02L =0.002mol,;b点时溶质为NaY和HY,HY部分电离,n(Y-)<0.002mol,溶液体积相同,则c(X-)> c(Y-),故B正确;C. HX为强酸,发生反应的离子方程式为H++OH-=H2O,故C错误;D. pH=7时,HX为强酸,n(X-)=0.1mol/L×0.02L=0.002mol,c(X-)=0.05 mol/L;HY为弱酸,pH=7时c(H+)=c(OH-),溶质为NaY和HY,根据电荷守恒,有c(Y-)= c(Na+),由于氢氧化钠溶液的体积小于HY溶液的体积,则c(Y-)=c(Na+)<0.05 mol/L,因此c(Y-)<c(X-),故D错误;故选B。

【题目】在2 L密闭容器内,充入一定量的NO和O2,800 ℃时发生反应2NO(g)+O2(g) ![]() 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1 s~2 s内,O2的物质的量减少________mol。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2s内该反应的平均速率v=________。
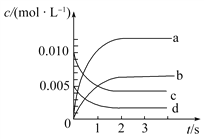
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变