��Ŀ����
����Ŀ���������Һ����ѧ��ѧ�еķdz���Ҫ��֪ʶ�㣬�����Ҫ����ա�
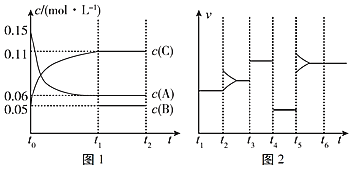
��1����NaHSO3��Һ�μ�ʯ����Һ���죬��HSO3-�ĵ���̶�___��ˮ��̶ȣ�����>��������������<��������������___�������ٽ���������������ˮ�ĵ��롣
��2������к͵ζ�ʱ��������___�����̪����ʯ����ȡ� ������ָʾ�����ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ�������___������ĸ����
A.δ�ñ�Һ��ϴ��ʽ�ζ���
B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
D.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
��3�����ᣨCH3COOH����һ��������ʣ�25��ʱ������ĵ���ƽ�ⳣ������ʽKa��___��
�ٽ�����������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��___������������������������������������ͬ������Һ��c(Na��)___c(CH3COO��)������>��������������<������
��pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��___�������ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ��c(Na��)=c(CH3COO��)�����Ϻ���Һ��___��
��4������a.���ᡢb.���ᡢc.����������Һ������Ҫ����⡣
�����������ʵ���Ũ����ȣ����ǵ�pH�ɴ�С�Ĺ�ϵΪ___����abc��ʾ����ͬ����
�������ǵ�pH��ȣ��������ʵ���Ũ���ɴ�С�Ĺ�ϵΪ___��
�������ǵ�pH��ȣ�����ˮϡ��100������pH�ɴ�С�Ĺ�ϵΪ___��
���𰸡��� ���� ʯ�� A��C Ka=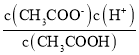 ���� �� ���� ���� a��b��c a��b��c b=c��a
���� �� ���� ���� a��b��c a��b��c b=c��a
��������
(1)NaHSO3��Һ�д���HSO3-�ĵ����ˮ��ƽ�⣬��NaHSO3��Һ�μ�ʯ����Һ���죬��Һ�����ԣ��ݴ˷������
(2)����к͵ζ�ʱ������ʯ��ı�ɫ�����ԣ���������ָʾ�����ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ��������c(����)=![]() �ж���
���
(3)�ٴ���Ϊ���ᣬ������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ�ǡ�����ɴ����ƣ�Ϊǿ�������Σ���Һ�ʼ��ԣ���ϵ���غ��жϣ��ڳ����£�pH=3�Ĵ���Ũ�ȴ���pH=11��NaOH��Һ�����ߵ������Ϻ������ʣ�࣬��Һ�����ԣ����ݵ���غ��жϣ�
(4)��Ũ����ͬ����ҺpH����Һ��������Ũ�ȳɷ��ȣ���pH��ͬʱ����Һ��������Ũ����ͬ��������һԪ���ᣬ�����Ƕ�Ԫǿ�ᡢ������һԪǿ�ᣬ�ݴ��жϣ���pH���ʱ��c(H+)��ȣ�������ϡ�����У���ٽ����룬���������ϡ��ʱ�����ӵ����ʵ������䣬�ݴ˷����жϡ�
(1)NaHSO3��Һ�д���HSO3-�ĵ����ˮ��ƽ�⣬��NaHSO3��Һ�μ�ʯ����Һ���죬��Һ�����ԣ�˵��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�NaHSO3��Һ�����ԣ��Ե���Ϊ������������������ܹ�����ˮ�ĵ��룬�ʴ�Ϊ���������ƣ�
(2)����к͵ζ�ʱ������ʯ��ı�ɫ�����ԣ���������ָʾ�����ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ����A.δ�ñ�Һ��ϴ��ʽ�ζ��ܣ�ʹ�ñ�����������ҺŨ��ƫС���ζ����ĵ������������ƫ����c(����)=![]() ��c(����)ƫ��A��ȷ��B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ����Ӱ����������ʵ����������������Ƶ�������Խ����Ӱ�죬��B����C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ����������������Һ�����ƫ����c(����)=
��c(����)ƫ��A��ȷ��B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ����Ӱ����������ʵ����������������Ƶ�������Խ����Ӱ�죬��B����C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ����������������Һ�����ƫ����c(����)=![]() ��c(����)ƫ��C��ȷ��D.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ����������������Һ�����ƫС������c(����)=
��c(����)ƫ��C��ȷ��D.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ����������������Һ�����ƫС������c(����)=![]() ��c(����)ƫС����D����ѡAC���ʴ�Ϊ��ʯ�AC��
��c(����)ƫС����D����ѡAC���ʴ�Ϊ��ʯ�AC��
(3)����Ϊ������ʣ�����CH3COOH![]() CH3COO-+H+������ĵ���ƽ�ⳣ������ʽKa��
CH3COO-+H+������ĵ���ƽ�ⳣ������ʽKa��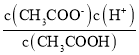 ���ʴ�Ϊ��
���ʴ�Ϊ��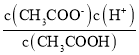 ��
��
�ٽ�������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ�ǡ������CH3COONa��Ϊǿ�������Σ���Һ�ʼ��ԣ�c(OH-)��c(H+)����Һ�д��ڵ���غ㣺c(CH3COO-)+c(OH-)=c(Na+)+c(H+)����c(Na+)��c(CH3COO-)���ʴ�Ϊ�����ԣ�����
�ڳ����£�pH=3�Ĵ���Ũ�ȴ���pH=11��NaOH��Һ�����ߵ������Ϻ������ʣ�࣬��Һ�����ԣ������ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ��c(Na��)=c(CH3COO��)�����ݵ���غ��֪��c(Na+)+c(H+)=c(OH-)+c(CH3COO-)����c(H+)=c(OH-)����ҺΪ���ԣ��ʴ�Ϊ�����ԣ����ԣ�
(4)�ٵ����ǵ����ʵ���Ũ����ͬʱ�����趼��1mol/L��������������Ũ��С��1mol/L��������������Ũ����2mol/L��������������Ũ����1mol/L��������Ũ��Խ��pHԽС������pH�ɴ�С������a��b��c���ʴ�Ϊ��a��b��c��
�� pH��ͬʱ����Һ��������Ũ����ͬ��������һԪ���ᣬ�����Ƕ�Ԫǿ�ᡢ������һԪǿ�ᣬ����������Ũ��Ϊ1mol/L�������Ũ�ȴ���1mol/L������Ũ����1mol/L������Ũ����0.5mol/L���������ʵ���Ũ�ȵ��ɴ�С������a��b��c���ʴ�Ϊ��a��b��c��
��pH���ʱ��c(H+)��ȣ�������ϡ�����У���ٽ����룬���������ӵ����ʵ������ӣ������ӵ�Ũ�ȼ�С�ij̶�С�������������Һ�����������ʵ�����������ȣ������ӵ�Ũ�ȼ�С�ij̶ȴ�����c(H+)�ɴ�С��˳��Ϊ��a��b=c��pH�ɴ�С��˳��Ϊb=c��a���ʴ�Ϊ��b=c��a��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ҵ�ϻ�������ij�Ͻ����(��Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe�����еȻ��ý���)�Ĺ����������£�
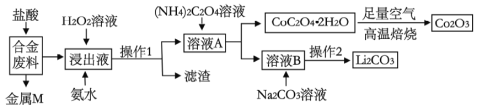
(1)�Ͻ�����м��������ȡ���˴�����ܻ�Ϊ���ᣬԭ����_______________��
(2)����1�õ��IJ���������__________________________��
(3)����Һ�м���H2O2��Һ�Ͱ�ˮ��Ӧ�ȼ���_____________�����백ˮ������Ӧ�����ӷ���ʽΪ____________________��
(4)�ڿ����б���CoC2O4��2H2O�Ļ�ѧ����ʽ��____________________��
(5)��֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±�
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
�����2�ľ���������_______________��_____________��ϴ�ӡ����
����Ŀ��ʵ����������ʯ�����Һ����Ҫ��Fe3+������һ������Al3+��Mn2+��Ca2+��Mg2+�ȣ�Ϊԭ���Ʊ��ߴ����������������£�

��֪��������ؽ������������������������pH���±���
�������� | Fe3+ | Fe2+ | Al3+ |
��ʼ������pH | 1.1 | 5.8 | 3.0 |
������ȫ��pH | 3.2 | 8.8 | 5.0 |
��1������ԭ��ʱ��Ӧѡ��_____________������ĸ����
A��Zn�� B��NaClO��Һ C��Fe��
��2��������������Ҫ�ɷֳ���������MnF2�⣬������_____________���ѧʽ����
��3�������̡�ʱ����֪��Ksp(MnS)��4.65��10�C14��Ϊȷ��������ȫ[����Һ��c(Mn2��)��1.0��10�C6 mol��L1]��Ӧ������Һ��c(S2-)��_____________mol��L��1��
��4����������ʱ��������ҺpH�ķ�ΧΪ_____________��
��5����������ʱ����������K2Cr2O7��Һ����Ƿ����δ�������Ľ������ӣ��÷�Ӧ�����ӷ���ʽΪ_____________��
��6����������ʱ����Ӧ�¶�Ϊ85�������£���Ӧʱ��ͷ�Ӧ�յ�pH�����ij����ʵ�Ӱ��ֱ�����ͼ��ʾ������ѵĹ���������_____________��