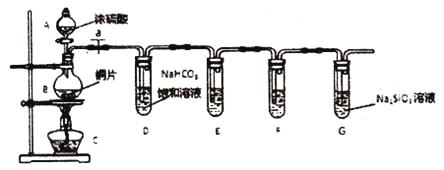
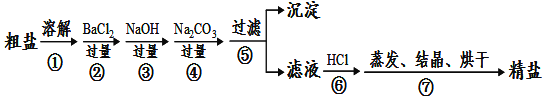
��Ŀ����
����Ŀ����1�����������У�����ǿ����ʵ���___������������ʵ���__�����ڷǵ���ʵ���__��������ţ�
�ٰ��� �ڴ����� ������ �ܴ��� �����ᱵ ������� ���Ҵ�
��2��һ�������£�������Һ���ڵ���ƽ�⣺CH3COOH![]() CH3COO����H����H��0
CH3COO����H����H��0
�����з����У���ʹ0.10mol��L��1������Һ��CH3COOH����ƽ�������Ƶ���___��
a����������0.10mol��L��1��ϡ���� b������
c����ˮϡ����0.010mol��L��1 d����������������
����֪��25��ʱ�������������ĵ���ƽ�ⳣ���ֱ�Ϊ�����K��1.75��10��5�������K1��1.54��10��2 K2��1.02��10��7����25��ʱ����ͬŨ�ȴ������������Һ������ǿ����CH3COOH___H2SO3(�����������������)��
��25��ʱ����0.10mol��L��1CH3COOH��Һ�м����������ᣬʹ��Һ��[OH��]=5.0��10��13mol��L��1�������Һ��pH��__������֪��lg2=0.3��
���𰸡��ڢ� �ܢ� �٢� a �� 1.7
��������
��1����ˮ��Һ���ܹ�ȫ������ĵ������ǿ����ʣ���ˮ��Һ���ܹ����ֵ���ĵ������������ʣ���ˮ��Һ������״̬������Ļ�����Ϊ�ǵ���ʣ�
��2���ٸ��ݵ���ƽ���Ӱ�����ؽ��з�����
����ĵ���ƽ�ⳣ��Խ����ĵ���̶�Խ������Խǿ��
�۸���c(H+)=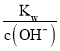 ��pH=-lg[c(H+)]���м��㣻
��pH=-lg[c(H+)]���м��㣻
��1���ٰ����Ƿǵ���ʣ��ڴ���������ǿ����ʣ��������ǻ������ǵ���ʣ�Ҳ���Ƿǵ���ʣ��ܴ��������ᣬ����������ʣ������ᱵ��ǿ����ʣ�������������ᣬ����������ʣ����Ҵ����ڷǵ���ʣ��������ǿ����ʵ��Ǣڢݣ�����������ʵ��Ǣܢޣ����ڷǵ���ʵ��Ǣ٢ߣ�
��2����a����������0.10mol��L��1��ϡ���ᣬ������H+��Ũ�ȣ�ƽ�������ƶ���a����ȷ��
b������ʵĵ���ʱ���ȵĹ��̣�����ʹ�¶����ߣ�ƽ�������ƶ���b�����
c����ˮϡ�ʹٽ��˴���ĵ��룬ƽ�������ƶ���c�����
d���������������ᣬ�����˷�Ӧ���Ũ�ȣ�ƽ�������ƶ���d�����
��ѡa��
����ĵ���ƽ�ⳣ��Խ������Խǿ������ĵ���ƽ�ⳣ��K��1.75��10��5���������һ������ƽ�ⳣ��K1��1.54��10��2��K<K1����ˣ���ͬŨ�ȴ������������Һ������ǿ����CH3COOH<H2SO3��
��c(H+)=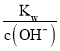 =
=![]() =2��10-2mol/L��pH=-lg[c(H+)]=2- lg2=2-0.3=1.7��
=2��10-2mol/L��pH=-lg[c(H+)]=2- lg2=2-0.3=1.7��

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�