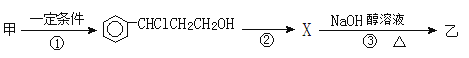题目内容
【题目】已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)该反应的化学平衡常数表达式K=____________ 。
(2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A H2S B COS C CO2 D N2
(3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字)
(4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。
【答案】![]() C 10% 2.8×10-3 > <
C 10% 2.8×10-3 > <
【解析】
由题意知①通入H2S,平衡正向移动,但自身转化率减小;通入CO2,平衡正向移动;通入COS,平衡逆向移动;恒容条件下通入N2,平衡不移动。②在600 K重复实验,平衡后水的物质的量分数为0.03,说明升高温度平衡逆向移动;③利用“三段式”计算平衡转化率以及反应平衡常数。
(1)反应方程式为H2S(g)+CO2(g)![]() COS(g)+H2O(g)则化学平衡常数表达式
COS(g)+H2O(g)则化学平衡常数表达式![]() ;
;
故答案为![]() ;
;
(2)A.充入H2S,浓度增大,平衡正向移动,H2S的转化率减小,故A选项错误;
B.充入COS,平衡逆向移动,H2S的转化率减小,故B选项错误;
C.充入CO2,平衡正向移动,H2S的转化率增大,故C选项正确;
D.充入N2,平衡不移动,H2S的转化率不变,故D选项错误;
故答案选C;
(3)由题意设H2S转化的物质的量为x,
H2S(g)+CO2(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
起始(mol)0.40 0.10 0 0
转化(mol) x x x x
平衡(mol)0.40-x 0.10-x x x
已知反应平衡后水的物质的量分数为0.02,则![]() =0.02,解得x=0.01,故CO2的平衡转化率a1=
=0.02,解得x=0.01,故CO2的平衡转化率a1=![]() ×100%=10%;反应平衡常数K=
×100%=10%;反应平衡常数K=![]() ≈2.8×10-3;
≈2.8×10-3;
故答案为10% 2.8×10-3;
(4)水的物质的量分数增大,说明升高温度平衡逆向移动,CO2的转化率a2>a1,且正反应放热,即△H<0;
故答案为> <。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案