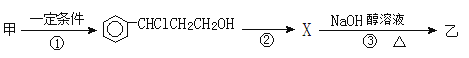题目内容
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。5min末达到平衡,有关数据如表。
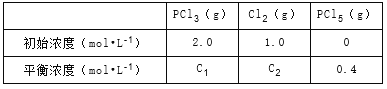
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08molL-1min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达平衡时,c(PCl5)<0.2molL-1
【答案】A
【解析】
A、若升高温度,反应的平衡常数减小,说明平衡向逆反应方向移动,故正反应为放热反应,故A错误;
B、由表中数据可知,平衡时![]() ,根据方程式可知
,根据方程式可知![]() ,
,![]() ,故B正确;
,故B正确;
C、平衡时![]() ,根据方程式可知
,根据方程式可知![]() ,
,![]() ,故平衡时
,故平衡时![]() 的物质的量为
的物质的量为![]() ,因此容器中Cl2为1.2mol时,可逆反应达到平衡状态,故C正确;
,因此容器中Cl2为1.2mol时,可逆反应达到平衡状态,故C正确;
D、平衡后移走![]() 和
和![]() 到达的平衡,等效为开始
到达的平衡,等效为开始![]() 为
为![]() 、
、![]() 为
为![]() 到达平衡,反应物的浓度变为原平衡的一半,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低,故相同条件下再达平衡时,
到达平衡,反应物的浓度变为原平衡的一半,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低,故相同条件下再达平衡时,![]() ,故D正确;
,故D正确;
故选 A。

【题目】下列有关物质检验的实验操作、现象及结论均正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
A.AB.BC.CD.D
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。