题目内容
5.吸收能量的反应一定是( )| A. | 贮存能量 | B. | 释放能量 | ||
| C. | 生成物稳定性大于反应物的稳定性 | D. | 原子得到电子的反应 |
分析 吸热反应:反应中生成物总能量高于反应物总能量.常见的吸热反应有:个别的化合反应(如C和CO2),绝大数分解反应,少数分解置换以及某些复分解(如铵盐和强碱),据此即可解答.
解答 解:A.反应中生成物总能量高于反应物总能量,需从外界吸收能量贮存,是吸热反应,故A正确;
B.释放能量是指:反应物的总能量大于反应物的总能量是放热反应,故B错误;
C.能量越低越稳定,吸收能量,生成物的能量高,不稳定,故C错误;
D.原子得到电子的反应为氧化还原反应反应,与吸收热量无关,故D错误,故选A.
点评 本题考查了物质发生化学反应时释放能量时吸热或放热的判断,关键是掌握常见的放热和吸热反应,可以根据所学知识进行回答,题目难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
20.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 冶炼铬可采用铝热法 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
10.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 0.2mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2与足量的水充分反应,转移电子数为0.1NA | |
| D. | 1.5molNa2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
1.短周期元素A、B、C、D的原子序数依次递增,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,D元素原子最外层电子数为电子层数的2倍,四种元素原子的核电荷数之和为36.则下列叙述正确的是( )
| A. | C元素的单质在B元素的单质中燃烧,产物1mol与足量的水反应转移电子数为NA | |
| B. | 由上述元素形成的化合物只有一种具有漂白性 | |
| C. | B、C、D三种元素形成的化合物的水溶液用惰性电极电解时,溶液pH一定不变 | |
| D. | A、B形成化合物的沸点高于A、C形成化合物的沸点,因为前者分子间形成了氢键 |
18.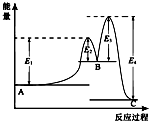 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 整个反应中△H=E1+E3-E2-E4 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 三种化合物中B最稳定 |
19.下列有关说法正确的是( )
| A. | Na2CO3和NaOH都能抑制水的电离 | |
| B. | 0.1 mol•L-1Na2CO3溶液加水稀释,CO32-的水解程度增大,溶液pH减小 | |
| C. | 酸碱中和滴定实验中,锥形瓶需用待测液润洗2~3次后,再加入待测液 | |
| D. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n |