题目内容
1.下列实验操作正确的是( )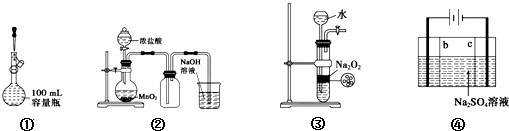
| A. | 装置①定容 | |
| B. | 装置②实验室制氯气 | |
| C. | 装置③用于制备少量氧气 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
分析 A.液面距离刻度线过远;
B.浓盐酸和二氧化锰反应需要加热;
C.过氧化钠为粉末固体,不能使反应随时停止;
D.④电解硫酸钠溶液,阴离子向阳极移动,在阳极上生成氧气和硫酸,阳离子向阴极移动,在阴极上生成氢气和氢氧化钠,以此选取离子交换膜.
解答 解:A.加水离刻度线还有1到2厘米的时候,改用胶头滴管滴加,故A错误;
B.浓盐酸和二氧化锰反应需要加热,不加热不反应,故B错误;
C.过氧化钠为粉末固体,不能使反应随时停止,则图中装置不能制备少量氧气,故C错误;
D.④电解硫酸钠溶液,阴离子向阳极移动,在阳极上生成氧气和硫酸,b应为阴离子交换膜,阳离子向阴极移动,在阴极上生成氢气和氢氧化钠,c应为阳离子交换膜,故D正确.
故选D.
点评 本题较为综合,涉及多个方面的知识,有对新教材《实验化学》的强调,实验装置的熟悉度,电解池装置中离子交换膜的知识点,题目难度中等,注意把握离子交换膜的判断.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
11.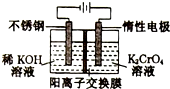 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
9.某同学设计如下实验测量m g铜银合金样品中铜的质量分数:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 收集到的V L气体都是NO | |
| B. | 过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | |
| C. | 操作Ⅱ应是洗涤 | |
| D. | 根据题中已知条件不能求出合金中铜的质量分数 |
10.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 0.2mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2与足量的水充分反应,转移电子数为0.1NA | |
| D. | 1.5molNa2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
15.下列微粒可以大量共存于同一溶液中的是( )
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Ca2+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5O-、Fe3+、H+、Cl- |
 海洋是巨大的资源宝库,具有美好的前景.
海洋是巨大的资源宝库,具有美好的前景. 所示.
所示.